Bromhistorie, struktur, elektronisk konfigurasjon, egenskaper, bruk

- 5079
- 1022
- Prof. Oskar Aas
Han brom Det er et ikke -metallisk element som tilhører Halogens Group, Group 17 (VIIA) i det periodiske tabellen. Det kjemiske symbolet er BR. Det presenteres som et diatomisk molekyl, hvis atomer er forent av en kovalent binding, så den molekylære formelen er tildelt2.
I motsetning til fluor og klor, er brom i terrestriske forhold ikke en gass, men en rødbrun væske (nedre bilde). Det er røyking, og det er sammen med Merkur, de eneste flytende elementene. Under den kan jodet, selv om fargen intensiveres og blir lilla, krystalliseres i et flyktig fast stoff.
 Hetteglass med ren flytende brom. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Hetteglass med ren flytende brom. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Bromo ble oppdaget, uavhengig av 1825 av Carl Löwig, som studerte under ledelse av den tyske kjemikeren Leopold Gmelin; Og i 1826, av den franske kjemikeren Antoine-Jerome Ballard. Imidlertid gikk publiseringen av de eksperimentelle resultatene av Balard foran Löwig.
Bromo er det 62. mest tallrike elementet på jorden, og blir fordelt i lave konsentrasjoner av jordens cortex. I havet er den gjennomsnittlige konsentrasjonen 65 ppm. Menneskekroppen inneholder en 0,0004 % brom, som ikke definitivt kjenner dens funksjon.
Dette elementet blir kommersielt utnyttet i Salmuelas eller steder som ved spesielle forhold er høye salter; For eksempel konverterte det døde havet, som vannene i de nærliggende territoriene, mettet med salter.
Det er et etsende element som er i stand til å angripe metaller, for eksempel platina og paladium. Oppløst i vann, kan brom også utøve sin etsende handling på menneskelig vev, og forverrer situasjonen fordi bromtersyre kan genereres. Når det gjelder toksisiteten, kan det forårsake viktig skade på organer, som lever, nyrer, lunge og mage.
Bromen er veldig skadelig i atmosfæren, og er 40-100 ganger mer ødeleggende for ozonlaget enn klor. Halvparten av tapet av ozonlaget i Antarktis produseres av reaksjoner relatert til brometyl, forbindelse brukt som en fumigant.
Den har mange bruksområder, for eksempel: brannhemmere, blekemiddel, overflatedesinfeksjonsmiddel, drivstofftilsetningsstoff, mellomledd i beroligende produksjon, i fremstilling av organiske kjemikalier, etc.
[TOC]
Historie
Carl Löwig Work
Bromo ble oppdaget uavhengig og nesten samtidig av Carl Jacob Löwig, en tysk kjemiker i 1825, og av Antoine Balard, en fransk kjemiker i 1826.
Carl Löwig, en disippel av den tyske kjemikeren Leopold Gmelin, samlet vann fra en vår med dårlig Kreuznach og tilsatt klor; Etter tilsetningen av eteren rørte han blandingen av væsker.
Deretter ble eteren atskilt ved destillasjon og konsentrerte den ved fordampning. Som et resultat oppnådde han et rødbrunt stoff, som var bromen.
Antoine Balard Work
Balard, derimot, brukte aske av en brun alge. Dermed ble bromen som ble frigjort, klor gjennom det vandige materialet utsatt for ekstraksjon, der magnesiumbromidet, MGBR var til stede2.
Deretter ble materialet destillert i nærvær av mangandioksid og svovelsyre, og produserte røde damper som kondensert til en mørk væske. Balard trodde det var et nytt element og kalte ham Muride, avledet fra det latinske ordet Muria, som saltlaken ble utpekt.
Det kan tjene deg: levende materie: konsept, egenskaper og eksemplerDet har blitt påpekt at Balard endret navnet på Muride til Brôme med forslag fra Anglada eller Gay-Lussac, basert på det faktum at Brôme betyr pest, som definerer lukten av det oppdagede elementet.
Resultatene ble publisert av Belard i Annales of Chemie and Physique, før Löwig publiserte sine egne.
Bare fra 1858 ble brom produsert i viktige mengder; år der stassfurt saltforekomster ble oppdaget og utnyttet, og oppnådde brom.
Elektronisk bromstruktur og konfigurasjon
Molekyl
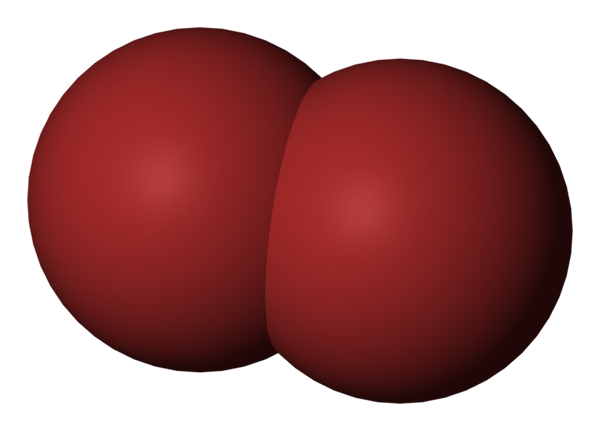 BR2 -molekyl. Kilde: Benjah-BMM27 [Public Domain].
BR2 -molekyl. Kilde: Benjah-BMM27 [Public Domain]. I det øvre bildet vises brommolekylet, BR2, Med en kompakt fyllingsmodell. Egentlig er det en enkel kovalent binding mellom de to bromatomene, BR-BR.
Å være et diatomisk og homogent molekyl, det mangler permanent dipolmoment og kan bare samhandle med andre av samme type gjennom spredningskrefter i London.
Dette er grunnen til at den rødlige væsken din røyker; I BR -molekyler2, Mens de er relativt tunge, holder deres intermolekylære krefter dem svakt koblet.
Bromo er mindre elektronegativ enn klor, og utøver derfor en lavere attraksjonseffekt på elektronene til Valencia -lagene. Som et resultat krever det mindre energi for å reise høyere energinivå, absorbere grønne fotoner og reflektere en rødlig farge.
Krystaller
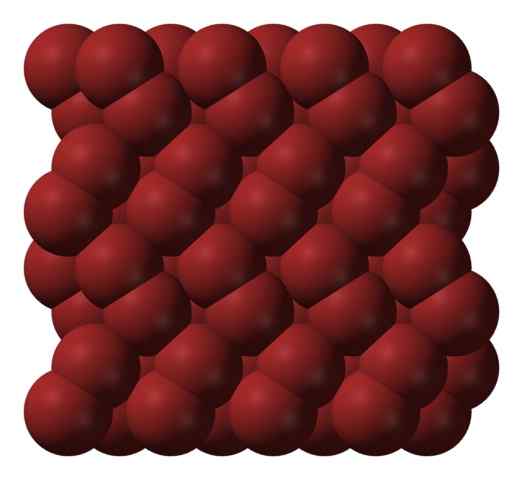 Bromo krystallinsk struktur. Kilde: Ben Mills [Public Domain].
Bromo krystallinsk struktur. Kilde: Ben Mills [Public Domain]. I en gassfase, BR -molekyler2 De skiller seg betydelig til det er effektive interaksjoner mellom dem. Under smeltepunktet kan imidlertid brom fryses i rødlig ortorrombiske krystaller (overlegen bilde).
Legg merke til hvordan BR -molekyler2 De er plassert ordnet på en slik måte at de virker "bromorm" ". Her og ved disse temperaturene (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valencia lag og oksidasjonstilstander
Den elektroniske bromkonfigurasjonen er:
[AR] 3D104s2 4p5
Å være 3D104s2 4p5 dets valenslag (selv om 3D -orbitalen10 Ikke ha prominens i dine kjemiske reaksjoner). Elektronene i 4S- og 4P -orbitalene er de ytterste og legger til totalt 7, bare ett elektron for å fullføre oktetten til Valencia.
Fra denne konfigurasjonen kan mulige oksidasjonstilstander trekkes ut for brom: -1, hvis et elektron får isolert for Kripton; +1, å være som 3D104s2 4p4; +3, +4 og +5, og mister alle elektronene i 4P -orbitalen ([AR] 3D104s24p0); og +7, løpe uten elektroner i 4S orbital ([AR] 3D104s04p0).
Egenskaper
Fysisk utseende
Liten mørkebrun rødlig væske. Det finnes i naturen som et diatomisk molekyl, med atomer samlet av en kovalent binding. Bromo er en tettere væske enn vann og synker ned i den.
Kan tjene deg: radio: struktur, egenskaper, bruk, skaffeAtomvekt
79.904 g/mol.
Atomnummer
35.
Lukt
En dekar røyk, kvelende og irriterende.
Smeltepunkt
-7.2 ºC.
Kokepunkt
58,8 ºC.
Tetthet (Br2) væske
3.1028 g/cm3
Vannløselighet
33,6 g/l a 25 ° C. Løseligheten av brom i vann er lav og har en tendens til å øke ved å redusere temperaturen; atferd som ligner på andre gasser.
Løselighet
Fritt løselig i alkohol, eter, kloroform, karbontetraklorid, karbondisulfid og konsentrert saltsyre. Løselig i ikke -polare løsningsmidler og litt polar som alkohol, svovelsyre og i mange halogenerte løsningsmidler.
Trippelpunkt
265,9 K ved 5,8 kPa.
Kritisk punkt
588 K på 10,34 MPa.
Fusjonsvarme (BR2)
10.571 kJ/mol.
Fordampningsvarme (BR2)
29,96 kJ/mol.
Molar kalorikapasitet (BR2)
75,69 kJ/mol.
Damptrykk
Ved en temperatur på 270 K, 10 kPa.
Selv -tisningstemperatur
Ikke brannfarlig.
tenningspunkt
113 ºC.
Lager temperatur
2 til 8 ºC.
Overflatespenning
40,9 mn/m a 25 ºC.
Lukt terskel
0,05 - 3,5 ppm. 0,39 mg/m3
Refraction Index (ηd)
1 6083 til 20 ºC, og 1 6478 til 25 ºC.
Elektronegativitet
2.96 på Pauling -skalaen.
Ioniseringsenergi
- Første nivå: 1.139,9 kJ/mol.
- Andre nivå: 2.103 kJ/mol.
- Tredje nivå: 3.470 kJ/mol.
Atomisk radio
120 pm.
Radiokovalent
120.3 pm.
Van der Waals radio
185 pm.
Reaktivitet
Det er mindre reaktivt enn klor, men mer reaktiv enn jod. Det er en oksidant som er mindre sterk enn klor og sterkere enn jod. Det er også et svakere reduksjonsmiddel enn jod, men sterkere enn klor.
Klordamp er svært etsende for mange materialer og menneskelig vev. Den angriper mange metallelementer, inkludert platina og paladium; Men det angriper ikke bly, nikkel, magnesium, jern, sink og under 300 ºC enten til natrium.
Bromo i vannet opplever en forandring og forvandles til bromid. Det kan også eksistere som en brom (bro3-), Avhengig av væske -pH.
På grunn av dens oksidasjonshandling kan brom indusere frigjøring av oksygenfrie radikaler. Dette er sterke oksidanter og kan forårsake vevsskader. Også brom kan produsere spontan tenning når det kombineres med kalium, fosfor eller tinn.
applikasjoner
Bensintilsetningsstoff
Etylen -dibromid ble brukt til å eliminere mulige blyforekomster i bilmotorer. Etter forbrenningen av bensin, som brukte bly som tilsetningsstoff, ble bromen kombinert med bly til form blybromid, en flyktig gass som ble utvist av eksosrøret.
Mens bromen eliminerte ledningen fra bensin, var dens destruktive handling på ozonlaget veldig kraftig, og det er derfor den ble kastet for denne applikasjonen.
Plantevernmidler
Metylen eller brometylbromid ble brukt som plantevernmiddel for å rense jordsmonn, spesielt for å eliminere parasittiske nematoder, for eksempel anylostom.
Imidlertid er bruken av de fleste forbindelsene som inneholder brom blitt kastet, igjen, ødeleggende på ozonlaget.
Kvikksølvutstedelseskontroll
Bromo brukes i noen planter for å redusere kvikksølvutslipp, veldig giftig metall.
Kan tjene deg: gravimetri: gravimetrisk analyse, metoder, bruksområder og eksemplerFotografi
Sølvbromid, i tillegg til sølv yoduro og sølvklorid, brukes som en lysfølsom forbindelse i fotografiske emulsjoner.
Terapeutiske handlinger
Kaliumbromid, så vel som litiumbromid, ble brukt som generelle beroligende midler på 1800 -tallet og begynnelsen av det tjuende århundre. Enkle salter brukes fremdeles i noen land som antikonvulsjoner.
Imidlertid godkjenner USAs FDA ikke bruken av brom for behandling av noen sykdom i dag.
Brann retarder
Bromen transformeres av flammene til bromhorinsyre, som forstyrrer oksidasjonsreaksjonen som oppstår under brann, og produserer dens utryddelse. Polymerer inneholder brom brukes til å lage brannhemmende harpikser.
Mattilsetningsstoff
Kaliumbromatspor til mel er lagt til for å forbedre matlagingen.
Kjemiske reagenser og mellomledd
Hydrogenbromid brukes som et reduksjonsmiddel og katalysator for organiske reaksjoner. Bromo brukes som kjemisk mellomledd i fremstilling av medisiner, hydrauliske væsker, kjølemedier, avfuktere og i forberedelser for å bølge håret.
Den finner også bruk i utdyping av brønnboringsvæsker, produkter for desinfeksjon av vann, hvitaktige midler, overflate -desinfeksjonsmidler, fargestoffer, tilsetningsstoffer, etc.
Biologisk handling
En studie utført i 2014 indikerer at brom er en nødvendig kofaktor for biosyntese av kollagen IV, noe som gjør brom til et essensielt element for utvikling av dyrevev. Det er imidlertid ingen informasjon om konsekvensene av et underskudd av elementet.
Hvor befinner det seg
Bromo er kommersielt hentet fra saltgruver og dype Salmuelas -brønner som finnes i delstaten Arkansas, og i den store salte innsjøen Utah, begge i USA. Denne siste saltlaken har en 0,5 % bromkonsentrasjon.
Å trekke ut brom.
Dødehavet, på grensen mellom Jordan og Israel, er et lukket hav som er under havnivå, noe som gjør det til en veldig høy konsentrasjon av salter.
Bromo og Potassa oppnås kommersielt der, ved fordampning av vann med høyt salt av det døde havet. I dette havet kan bromkonsentrasjonen nå 5 g/l.
Det finnes også i høye konsentrasjoner i noen varme kilder. Bominita, for eksempel, er et sølvbromidmineral som finnes i Bolivia og Mexico.
Risiko
Bromin i flytende tilstand er etsende for menneskelig vev. Men den største faren for mennesket kommer fra bromdamp og innånding.
Pust i et miljø med en bromkonsentrasjon på 11-23 mg/m3 Det gir alvorlige sjokk. En konsentrasjon på 30-60 mg/m3 Det er ekstremt skadelig. I mellomtiden kan en 200 mg konsentrasjon være dødelig.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Nasjonalt senter for bioteknologiinformasjon. (2019). Brom. PubChem -database. CID = 23968. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Ross Rachel. (8. februar 2017). Fakta om brom. Gjenopprettet fra: Livescience.com
- Wikipedia. (2019). Borax. Hentet fra: i.Wikipedia.org
- Lentech b. V. (2019). Brom. Gjenopprettet fra: Lentech.com
- « Myosinegenskaper, struktur, typer og funksjon
- Nucleas -egenskaper, struktur, typer og funksjoner »

