Broglie Atomic Model

- 3129
- 224
- Marius Aasen
Han Broglie Atomic Model Det ble foreslått av den franske fysikeren Louis Broglie i 1924. I sin doktorgradsavhandling sa Broglie at bølgepartikelen dualiteten til elektroner, og la grunnlaget for bølgende mekanikk. Broglie publiserte viktige teoretiske funn om Wave-Corpusculus Nature.
Deretter ble Broglies uttalelser demonstrert eksperimentelt av forskerne Clinton Davisson og Lester Germer, i 1927. Bølgeteorien til Broglie -elektronene er basert på Einsteins forslag om de bølgende egenskapene til lys i korte bølgelengder.
 Louis Broglie
Louis Broglie Broglie kunngjorde muligheten for at materie hadde en oppførsel som ligner lys, og antydet lignende egenskaper i subatomiske partikler som elektroner.
Elektriske og bane belastninger begrenser amplituden, lengden og frekvensen av bølgen beskrevet av elektroner. Broglie forklarte bevegelsen av elektroner rundt atomkjernen.
[TOC]
Kjennetegn på atommodellen til Broglie
For å utvikle forslaget sitt, startet Broglie fra prinsippet om at elektroner hadde en dobbel karakter mellom bølge og partikkel, likt lys.
I den forstand laget Broglie en likhet mellom de to fenomenene, og basert på ligningene utviklet av Einstein for studiet av den bølgende naturen til lys, sa følgende:
- Den totale energien til fotonet og følgelig den totale energien til elektronet, er resultatet av produktet av bølgefrekvensen og planken konstant (6 62606957 (29) × 10 -3. 4 Jules x sekunder), som beskrevet i følgende uttrykk:

I dette uttrykket:
E = elektronenergi.
H = Plank konstant.
F = bølgefrekvens.
- Det lineære øyeblikket av fotonet, og derfor, av elektronet, er omvendt proporsjonal med bølgens lengde, og begge størrelsene er relatert gjennom planken konstant:
Kan tjene deg: omvendt osmose: hvordan det fungerer, hva er det for, eksempler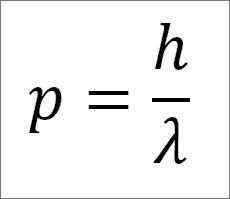
I dette uttrykket:
P = Lineært øyeblikk av elektronet.
H = Plank konstant.
λ = bølgelengde.
- Det lineære øyeblikket er produktet av massen til partikkelen på grunn av hastigheten som nevnte partikkel har under sin forskyvning.
Hvis det forrige matematiske uttrykket er omstrukturert avhengig av bølgelengden, er følgende:
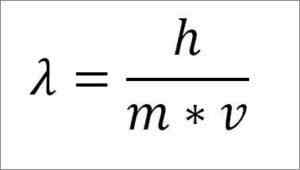
I det uttrykket:
λ = bølgelengde.
H = Plank konstant.
m = elektronmasse.
V = elektronhastighet.
Siden H, planken konstant, har en liten verdi, er bølgelengden λ også. Følgelig er det mulig å oppgi at bølgeegenskapene til elektronet bare presenteres på atom- og subatomisk nivå.
- Broglie er også basert på postulatene til atommodellen Bohr. I følge sistnevnte er elektroners baner begrensede og kan bare være multipler av hele tall. Så:
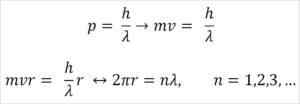
Hvor:
λ = bølgelengde.
H = Plank konstant.
m = elektronmasse.
V = elektronhastighet.
R = bane radius.
n = hele nummeret.
I følge Bohrs atommodell, som Broglie adopterte som base, hvis elektronene oppfører seg som stasjonære bølger, er de eneste tillatte banene de som har radius som er lik et helt multiplum av bølgelengden λ.
Derfor overholder ikke alle baner de nødvendige parametrene for et elektron å mobilisere gjennom disse. Her er grunnen til at elektroner bare kan bevege seg i spesifikke baner.
Bølgeteorien om Broglies elektroner rettferdiggjorde suksessen til Bohrs atommodell for å forklare den unike elektronatferden til hydrogenatom.
Kan servere deg: tørt batteriTilsvarende ga han også lys på hvorfor denne modellen ikke tilpasset seg mer komplekse systemer, det vil si atomer med mer enn ett elektron.
Davisson og Germer Experiment
Den eksperimentelle sjekken av atommodellen til Broglie fant sted 3 år senere av publiseringen, i 1927.
De fremtredende amerikanske fysikerne Clinton J. Davisson og Lester Germer bekreftet eksperimentelt teorien om bølgende mekanikk.
Davisson og Germer utførte spredningstester av en elektronstråle gjennom en nikkelkrystall og observerte fenomenet diffraksjon gjennom det metalliske miljøet.
Eksperimentet som ble utført besto av å utføre følgende prosedyre:
- I første omgang ble det plassert en montering med elektronstråle som hadde en kjent innledende energi.
- Det ble installert en spenningskilde for å akselerere elektronbevegelsen som fikk en potensiell forskjell.
- Strømmen av elektronstrålen til et metallisk glass ble rettet; I dette tilfellet, nikkel.
- Antall elektroner som traff nikkelglasset ble målt.
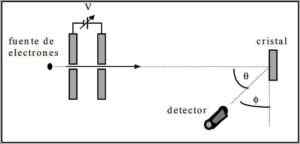
På slutten av eksperimentering oppdaget Davisson og Germer at elektronene spredte seg i forskjellige retninger.
Når man gjentar eksperimentet ved bruk av metallkrystaller med forskjellige orienteringer, oppdaget forskere følgende:
- Spredningen av elektronstrålen gjennom metallglasset var sammenlignbar med fenomenet interferens og diffraksjon av lysstrålene.
- Refleksjonen av elektroner på påvirkningsglasset beskrev banen som teoretisk sett skulle beskrive i henhold til Broglie Electron Wave Theory.
Kort sagt, Davisson og Germer-eksperiment beviste eksperimentelt den doble bølgepartikkelens natur av elektroner.
Kan tjene deg: Polar kovalent lenke: Kjennetegn og eksemplerBegrensninger
Broglies atommodell forutsier ikke den nøyaktige plasseringen av elektronet på bane der den beveger seg.
I denne modellen oppfattes elektroner som bølger som mobiliseres i hele bane uten et bestemt sted, som introduserer begrepet elektronisk orbital.

I tillegg vurderer ikke Broglies atommodell, analog med Schrödinger -modellen, rotasjonen av elektronene på samme akse (snurre rundt).
Ved å ignorere det iboende vinkelmomentumet til elektroner, blir de romlige variasjonene til disse subatomiske partiklene igjen til side.
I samme ordenrekkefølge tar denne modellen heller ikke hensyn til endringene i oppførselen til raske elektroner som et resultat av de relativistiske effektene.
Artikler av interesse
Schrödinger atommodell.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo atommodell.
Bohr atommodell.
Gjeldende atommodell.
Referanser
- Bohrs kvanteteori og de Broglie Waves (S.F.). Gjenopprettet fra: ne.Phys.Kyushu-U.Ac.J
- Louis de Broglie - Biografisk (1929). © The Nobel Foundation. Gjenopprettet fra: Nobelprize.org
- Louis-Victor de Broglie (S.F.). Hentet fra: Chemed.Chem.Purdue.Edu
- Lovett, f. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Gjenopprettet fra: Britannica.com
- De Broglie Atomic Model. National University of Distance Education. Spania. Gjenopprettet fra: OCW.Innova.Uned.er
- Louis de Broglie.F.). Gjenopprettet fra: Hiru.Eus
- Von pamel, eller., Og Marchisio, S. (s.F.). Kvantemekanikk. National University of Rosario. Gjenopprettet fra: FCEIA.a r.Edu.ar

