Schrödinger atommodell

- 2432
- 505
- Markus Fredriksen
Hva er Schrödingers atommodell?
Han Schrödinger atommodell Det er et forslag til operasjonen og strukturen til atomet utviklet av Erwin Schrödinger i 1926. Det er kjent som den kvantemekaniske modellen til atomet, og beskriver bølgeatferden til elektronet.
For dette var den enestående østerrikske fysikeren basert på Broglie -hypotesen, som uttalte at hver bevegelige partikkel er assosiert med en bølge og kan oppføre seg som sådan.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger antydet at bevegelsen av elektroner i atomet tilsvarte bølgepartikelen dualitet, og følgelig kunne elektronene mobilisere rundt kjernen som stasjonære bølger.
Schrödinger, som ble tildelt Nobelprisen i 1933 for sine bidrag til atomteori, utviklet den homonyme ligningen for å beregne sannsynligheten for at et elektron vil være i en spesifikk posisjon.
Schrödinger atomisk modellegenskaper
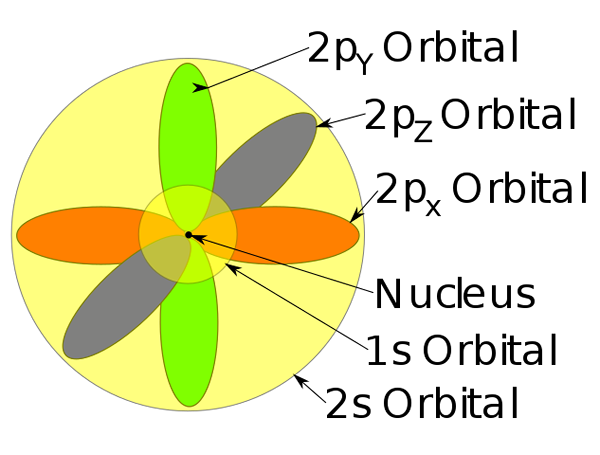 Orbitals 1s, 2s og 2p inne i et natriumatom.
Orbitals 1s, 2s og 2p inne i et natriumatom. -Denne atommodellen beskriver bevegelsen av elektroner som stasjonære bølger.
-Elektronene beveger seg konstant, det vil si at de ikke har en fast eller definert posisjon i atomet.
-Denne modellen forutsier ikke elektronstedet, og beskriver heller ikke ruten den lager innenfor atomet. Bare etablerer en sannsynlighetssone for å lokalisere elektronet.
-Disse sannsynlighetsområdene kalles atombaner. Orbitalene beskriver en oversettelsesbevegelse rundt atomets kjerne.
-Disse atomiske orbitalene har forskjellige nivåer og energi -undernivåer, og kan defineres mellom elektronskyer.
-Modellen tenker ikke på kjernenes stabilitet, den refererer bare til å forklare kvantemekanikken assosiert med bevegelse av elektroner i atomet.
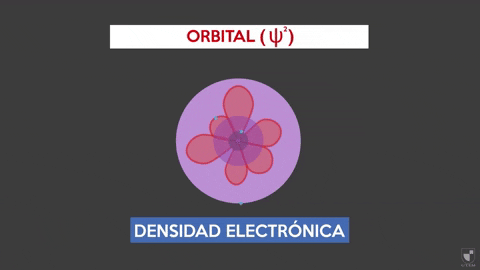 Elektronisk tetthet indikerer sannsynligheten for å finne et elektron nær kjernen. Jo nærmere kjernen (lilla sone) vil være mer sannsynlighet, mens det vil være mindre hvis du beveger deg bort fra kjernen (fiolett område).
Elektronisk tetthet indikerer sannsynligheten for å finne et elektron nær kjernen. Jo nærmere kjernen (lilla sone) vil være mer sannsynlighet, mens det vil være mindre hvis du beveger deg bort fra kjernen (fiolett område). Eksperiment
Schrödingers atommodell er basert på Broglie -hypotesen, samt de tidligere atommodellene til Bohr og Sommerfeld.
Kan tjene deg: dynamisk eller kinetisk friksjon: koeffisient, eksempler, øvelserBroglie foreslo at akkurat som bølger har partikler, har partikler bølgeegenskaper, med en tilhørende bølgelengde. Noe som genererte mye forventning den gangen, og var Albert Einstein selv på sin teori.
Imidlertid hadde Broglies teori mangel, som var at betydningen av egen idé ikke ble forstått veldig bra: et elektron kan være en bølge, men hva med hva? Det er da figuren til Schrödinger ser ut til å svare.
For å gjøre dette, stolte den østerrikske fysikeren på Youngs eksperiment, og basert på sine egne observasjoner utviklet han det matematiske uttrykket som bærer navnet hans.
Neste de vitenskapelige grunnlaget for denne atommodellen:
Youngs eksperiment: Den første demonstrasjonen av bølgepartikkel dualitet
Broglies hypotese om emnets bølgende og korpuskulære natur kan demonstreres ved Youngs eksperiment, også kjent som dobbeltspalteeksperiment.
Den engelske forskeren Thomas Young la grunnlaget for Schrödingers atommodell da han i 1801 gjennomførte eksperimentet for å bekrefte lysets bølgende natur.
Under eksperimenteringen delte Young utslippet av en lysstråle som krysser et lite hull gjennom et observasjonskammer. Denne divisjonen oppnås ved å bruke et 0,2 millimeter kort, plassert parallelt med bjelken.
Utformingen av eksperimentet ble laget for at lysstrålen skulle være bredere enn kortet, og dermed plasserte kortet horisontalt, ble bjelken delt inn i omtrent de samme delene. Utgangen til lysstrålene ble rettet av et speil.
Kan tjene deg: avstandsstyrkerBegge lysstråler traff en vegg i et mørkt rom. Der ble interferensmønsteret mellom de to bølgene bevist, noe som ble vist at lyset kunne oppføre seg så mye som en partikkel og en bølge.

Et århundre senere forsterket Albert Einsten ideen gjennom prinsippene om kvantemekanikk.
Schrödingers ligning
Schrödinger utviklet to matematiske modeller, og differensierte hva som skjer avhengig av om kvantetilstanden endres over tid eller ikke.
For atomanalyse publiserte Schrödinger i slutten av 1926.
Dette innebærer at bølgen ikke beveger seg, dens noder, det vil si dens likevektspunkter, fungerer som en pivot for resten av strukturen å bevege seg rundt dem, og beskriver en viss frekvens og amplitude.
Schrödinger definerte bølgene som beskriver elektroner som stasjonære eller orbitale tilstander, og er på sin side på sin side på forskjellige nivåer av energi.
Schrödingers uavhengige tidsligning er som følger:
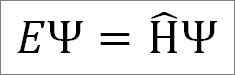
Hvor:
OG: Proporsjonalitetskonstant.
Ψ: Kvantesystembølgefunksjon.
Η ̂: Hamiltonian operatør.
Schrödingers uavhengige tidsligning brukes når den observerbare som representerer den totale energien til systemet, kjent som Hamiltonian operatør, ikke er avhengig av tiden. Imidlertid vil funksjonen som beskriver den totale bølgebevegelsen alltid avhenge av tiden.
Schrödingers ligning indikerer at hvis du har en bølgefunksjon ψ, og den Hamiltonian operatøren virker på den, representerer proporsjonalitetskonstanten og representerer den totale energien til kvantesystemet i en av sine stasjonære tilstander.
Det kan tjene deg: Diskret variabel: Karakteristikker og eksemplerBrukes på Schrödingers atommodell, hvis elektronet beveger seg i et definert rom, er det diskrete energiverdier, og hvis elektronet fritt er forskjøvet i rommet, er kontinuerlige energiintervaller hatt.
Fra det matematiske synspunktet er det flere løsninger for Schrödinger -ligningen, hver løsning innebærer en annen verdi for proporsjonalitetskonstanten og.
I følge Heisenbergs usikkerhetsprinsipp er det ikke mulig å estimere posisjonen eller energien til et elektron. Følgelig erkjenner forskere at estimeringen av elektronplassen i atomet er unøyaktig.
Postulater av Schrödinger atommodellen
Postulatene til Schrödinger -atommodellen er følgende:
-Elektronene oppfører seg som stasjonære bølger som er fordelt i rom i henhold til bølgefunksjonen ψ.
-Elektronene beveger seg inne i atomet som beskriver orbitaler. Dette er områder der sannsynligheten for å finne et elektron er betydelig høyere. Den nevnte sannsynligheten er proporsjonal med bølgefunksjonen ψ kvadratet ψ2.
Den elektroniske konfigurasjonen av Schrödinguer atommodellen forklarer de periodiske egenskapene til atomer og koblinger som dannes.
Schrödingers atommodell vurderer imidlertid ikke spinnet av elektroner, og vurderer ikke variasjonene av raske elektroner på grunn av relativistiske effekter på grunn av relativistiske effekter.
Artikler av interesse
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo atommodell.
Bohr atommodell.
Sommerfeld Atomic Model.
Gjeldende atommodell.
Referanser
- Den kvantemekaniske modellen til atomet utvunnet fra: det er.Khanacademy.org
- Schrödingers bølge ligning (s.F.). Jaime I University. Castellón, Spania. Gjenopprettet fra: Uji.er
- Moderne atomteori: modeller. © Abcte. Gjenopprettet fra: Abcte.org
- Schrodingers Atomic Mod.F.). Gjenopprettet fra: Erwinschrodingerbiography.Weebly.com
- Wikipedia, gratis leksikon. Schrödinger ligning. Gjenopprettet fra: er.Wikipedia.org
- Wikipedia, gratis leksikon. Ung eksperiment. Gjenopprettet fra: er.Wikipedia.org

