Sommerfeld Atomic Model -egenskaper, postulater, fordeler og ulemper
- 4358
- 544
- Markus Fredriksen
Han Sommerfeld Atomic Model Det ble opprettet av den tyske fysikeren Arnold Sommerfeld mellom 1915 og 1916, for å forklare fakta som Bohr -modellen, utgitt kort tid før i 1913, ikke kunne forklare tilfredsstillende tilfredsstillende. Sommerfeld presenterte resultatene først til Bayern.
Atommodellen foreslått av den danske fysikeren Niels Bohr beskriver.
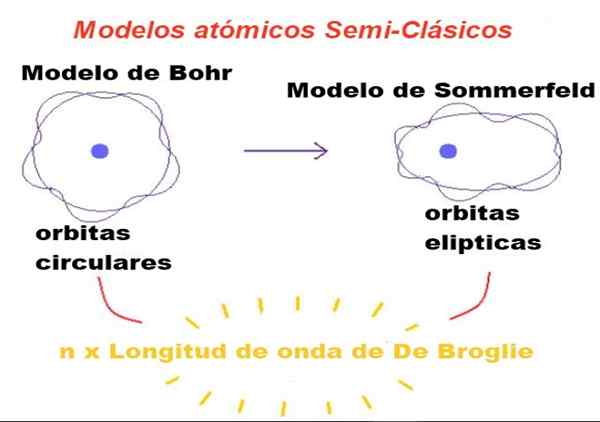
 Figur 1. I semiklassiske modeller er baner Newtonian, men bare de med omkrets er et heltall antall ganger broglie-bølgelengden er tillatt. Kilde: f. Zapata.
Figur 1. I semiklassiske modeller er baner Newtonian, men bare de med omkrets er et heltall antall ganger broglie-bølgelengden er tillatt. Kilde: f. Zapata. I teorien foreslått av Bohr, kan elektronet som går i bane rundt kjernen bare ha visse verdier av dets orbitale vinkelmoment, og derfor kan det ikke være i noen bane.
Bohr mente også at disse banene var sirkulære og et enkelt kvantetall kalt Hovedkvantumnummer n = 1, 2, 3 ... tjente til å identifisere de tillatte banene.
Den første modifiseringen introdusert av Sommerfeld til Bohr -modellen besto av å anta at elektronbane også kan være elliptisk.
En omkrets er beskrevet av dens radius, men for en ellipse må du gi to parametere: semi -senije og mindre halvsemi, i tillegg til den romlige orienteringen av det samme. Med dette introduserte han ytterligere to kvantetall.
Den andre hovedmodifiseringen som Sommerfeld gjorde var å legge til relativistiske effekter til atommodellen. Det er ingenting raskere enn lyset, men Sommerfeld hadde funnet elektroner med betydelig nære hastigheter, derfor var det nødvendig å inkorporere de relativistiske effektene i en beskrivelse av atomet.
[TOC]
Postulater av sommerfeld atommodellen
Elektroner følger sirkulære og elliptiske baner
Elektroner i atomet følger elliptiske bane (sirkulære baner er et spesielt tilfelle), og deres energistatus kan karakteriseres av 3 kvantetall: hovedkvantetallet n, Det sekundære kvantetallet eller azimutalt nummer l og det magnetiske kvantetallet mL.
Kan tjene deg: binære salterI motsetning til omkretsen, har en ellipse en større semije og en mindre halvdel.
Men ellipser med samme store semi -aks, de kan ha forskjellige mindre halvsemi, avhengig av graden av eksentrisitet. En eksentrisitet lik 0 tilsvarer en sirkel, så den utelukker ikke sirkulære baner. I tillegg kan ellipser i rommet ha forskjellige tilbøyeligheter.
Det er grunnen til at Sommerfeld la til modellenL. Dermed påpekte han hva som er de tillatte romlige orienteringene til den elliptiske bane.
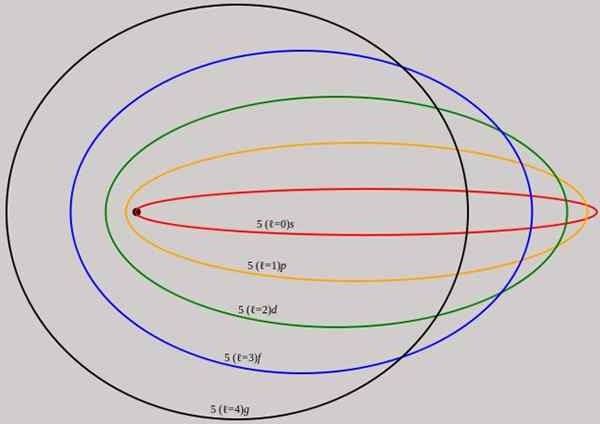 Figur 2. Banene som tilsvarer energinivået n = 5 er vist for forskjellige vinkelmoment l som har komplette bølgelengder av de Broglie. Kilde: Wikimedia Commons.
Figur 2. Banene som tilsvarer energinivået n = 5 er vist for forskjellige vinkelmoment l som har komplette bølgelengder av de Broglie. Kilde: Wikimedia Commons. Merk at det ikke legger til nye hovedkvantumnummer, så den totale energien til elektronet i elliptiske bane er den samme som i Bohr -modellen. Derfor er det ingen nye nivåer av energi, men en utfoldelse av nivåene gitt av nummer n.
Zeeman -effekt og sterk effekt
På denne måten er det mulig å spesifisere en gitt bane fullstendig, takket være de 3 kvantetallene som er nevnt og dermed forklare eksistensen av to effekter: Zeeman -effekten og den sterke effekten.
Og så forklarer utfoldelsen av energi som vises i den normale Zeeman -effekten (det er også en anomal Zeeman -effekt), der en spektral linje er delt inn i flere komponenter når den er i nærvær av et magnetfelt.
Denne utfoldelsen av linjene forekommer også i nærvær av et elektrisk felt, som er kjent som sterk effekt, som førte til at Sommerfeld tenkte på modifiseringen av Bohr -modellen for å forklare disse effektene.
Atomkjernen og elektronene beveger seg rundt massesenteret
Etter at Ernest Rutherford oppdaget atomkjernen og at det faktum at nesten hele massen av atomet er konsentrert der, mente forskere at kjernen var mer eller mindre stasjonær.
Det kan tjene deg: litiumhydroksid (LIOH)Sommerfeld postulerte imidlertid at både kjernen og elektronene i bane beveger seg rundt massesenteret av systemet, som selvfølgelig er veldig nær kjernen. Modellen bruker den reduserte massen av elektronet - kjerne -systemet, i stedet for elektronmassen.
I elliptiske baner, som med planetene rundt solen, er det tider hvor elektronet er nærmere, og i andre lenger fra kjernen. Derfor er hastigheten forskjellig på hvert punkt i bane.
 Figur 3.- Arnold Sommerfeld. Kilde: Wikimedia Commons. GFHUND [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)].
Figur 3.- Arnold Sommerfeld. Kilde: Wikimedia Commons. GFHUND [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Elektroner kan nå relativistiske hastigheter
Sommerfeld introduserte i sin modell konstanten av fin struktur, en konstant uten dimensjoner relatert til elektromagnetisk kraft:
α = 1/137.0359895
Det er definert som kvotienten mellom elektronbelastningen og Jeg kvadrater høyt, og produktet mellom Plancks konstante h og lysets hastighet c I et vakuum multiplisert alt med 2π:
α = 2π (e2/h.c) = 1/137.0359895
Den fine strukturen konstant relaterer tre av de viktigste konstantene av atomfysikk. Den andre er massen til elektronet, som ikke vises her.
På denne måten er det knyttet til elektronene med fotonene (som beveger seg med hastighet C i tomrommet), og dermed forklarer avvikene til noen spektrale linjer i hydrogenatomet i prediksjonene av BOHR -modellen.
Takket være relativistiske korreksjoner, energinivåer med likeverdige n Men annerledes l De skiller seg og gir opphav til den fine strukturstrukturen, derfra navnet på konstant α.
Og alle karakteristiske lengder på atomet kan uttrykkes i form av denne konstanten.
 Figur 4. Kvantisering av vinkelmoment l vises. I motsetning til sirkulære baner, elliptiske. Kilde: f. Zapata.
Figur 4. Kvantisering av vinkelmoment l vises. I motsetning til sirkulære baner, elliptiske. Kilde: f. Zapata. Fordeler og ulemper
Fordeler
-Sommerfeld viste at et enkelt kvantetall var utilstrekkelig for å forklare de spektrale linjene til hydrogenatom.
-Det var den første modellen som foreslo en romlig kvantisering, siden anslagene til banene i retning av det elektromagnetiske feltet er i virkeligheten kvantifisert.
Kan tjene deg: Plasmatilstand: Kjennetegn, typer og eksempler-Sommerfeld -modellen forklarte tilfredsstillende at elektroner med samme viktigste kvantetall n er forskjellige i energitilstanden sin, siden de kan ha forskjellige kvantetall l og mL.
-Introduserte den konstante α for å utvikle den fine strukturen i atomspekteret og forklare Zeeman -effekten.
-Det inkluderte de relativistiske effektene, siden elektroner kan bevege seg med hastigheter ganske nær lysets lys.
Ulemper
-Hans modell var bare anvendelig for atomer med et elektron og på mange måter til atomene til alkaliske metaller som Li2+, Men det er ikke nyttig i heliumatom, som har to elektroner.
-Forklarte ikke den elektroniske fordelingen i atomet.
-Modellen tillot å beregne energiene til de tillatte tilstandene og frekvensene til strålingen som er utstedt eller absorbert i overgangene mellom tilstander, uten å gi informasjon om tidene for disse overgangene.
-Nå er det kjent at elektroner ikke følger bane med forhåndsbestemte former som baner, men at de okkuperer Orbitaler, Romregioner som tilsvarer Schrodinger ligningsløsninger.
-Modellen vilkårlig kombinert klassiske aspekter med kvanteaspekter.
-Han klarte ikke å forklare anomal Zeeman -effekt, for dette er nødvendig av Dirac -modellen, som senere la til et annet kvantetall.
Artikler av interesse
Schrödinger atommodell.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Leucipo atommodell.
Bohr atommodell.
Gjeldende atommodell.
Referanser
- Brainkart. Sommerfeld Atom -modellen og dens ulemper. Gjenopprettet fra: Brainkart.com.
- Hvordan vi ble kjent med kosmos: lys og materie. Sommerfelds atom. Hentet fra: TastArgarden.co.Storbritannia
- Parker, s. Bohr-Sommerfeld-atomet. Gjenopprettet fra: Physnet.org
- Utdanningshjørne. Sommerfeld -modell. Gjenopprettet fra: Rinconucative.com.
- Wikipedia. Sommerfeld Atomic Model. Gjenopprettet fra: er.Wikipedia, org.
- « Hva er jordens naturlige komponenter?
- Generelle formel kvadratiske ligninger, eksempler, øvelser »

