Korpuskulær modell av materie
- 1854
- 161
- Prof. Theodor Gran
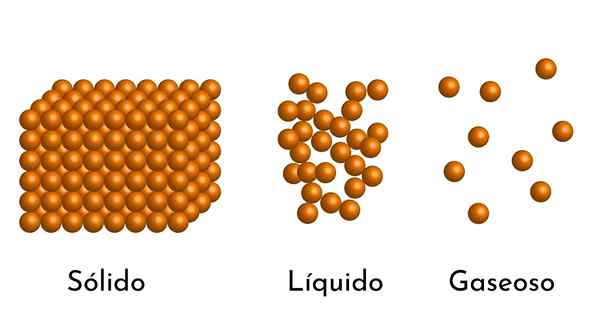
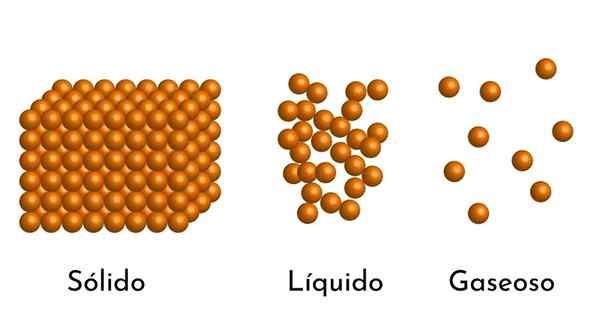 De mest kjente tilstandene i saken har sin forklaring i den korpuskulære modellen av saken
De mest kjente tilstandene i saken har sin forklaring i den korpuskulære modellen av saken Hva er den korpuskulære modellen for materie?
Han Korpuskulær modell av materie Det er en modell av den mikroskopiske strukturen til materie, som søker å forklare egenskapene og atferden i hver aggregeringstilstand.
Det grunnleggende postulatet av modellen er at materie består av små partikler, som kan være atomer, ioner eller molekyler, alltid i kontinuerlig agitasjon.
I denne modellen gjelder lovene i klassisk mekanikk for partikler, selv om de av det store antallet er til stede, blir de ikke studert individuelt, men gjennom en statistisk behandling. På denne måten oppnås gjennomsnittsverdiene for de makroskopiske størrelsene av interesse, for eksempel trykk, temperatur og volum.
Den korpuskulære modellen forklarer også egenskaper som viskositet, hardhet, fleksibilitet og tetthet av materialer, samt termisk utvidelse, blant andre fenomener.
Opprinnelse til den korpuskulære modellen av materie
Ideene om den korpuskulære naturen til materiedato minst det 5. århundre.C. I det gamle Hellas, Leucipo (450 A. C. - 370 a. C.) og demokritus (460 til 370 til C), hadde disippel av det spekulert i organiseringen av materie på mikroskopisk nivå.
Disse filosofene foreslo at saken er sammensatt av bittesmå udelelige partikler, utnevnt atomer, Et ord med gresk rot som betyr nøyaktig "udelelig".
Teorien ble utelukket av Aristoteles, den mest innflytelsesrike vismannen i sin tid. Imidlertid var det først på det syttende århundre at corpuskulær teori begynte å ta relevans igjen, og på 1800 -tallet begynte sakenes hemmeligheter å avsløre.
I 1803 foreslo den engelske kjemikeren John Dalton (1766-1844) igjen at saken ble dannet av korpuskler kalt atomer, som kombinerte i visse proporsjoner for å danne molekylene til et stoff.
Daltons atomer var udelelige, men snart ble en solid teoretisk struktur utviklet, spesielt takket være James C. Maxwell (1831-1979) og Ludwig Boltzmann (1844-1906). Dette etablerte grunnlaget for statistisk mekanikk og fysikken i fast tilstand.
Det kan tjene deg: Gjennomsnittlig hastighet: Formler, hvordan den beregnes og løsesGrunnleggende om den korpuskulære modellen for materie
De viktigste postulatene til modellen er:
- Materiale, uavhengig av deres status for aggregering, dannes av mikroskopiske partikler, som kan være individuelle eller kombinasjonsatomer, for å danne molekyler.
- De forskjellige stoffene skiller seg fra hverandre fordi de er sammensatt av forskjellige partikler.
- I henhold til tilstanden for aggregering av materie er det tomme rom mellom partiklene, større i gassene og mindre i faste stoffer.
- Partiklene som utgjør saken er i evigvarende agitasjon. Til større agitasjon, større kinetisk energi de har, og hvis varmen tilsettes, økes bevegelsen av partiklene.
- I væsker og faste stoffer opplever partiklene attraksjon av ulik intensitet, på grunn av intermolekylære krefter. I gasser er molekylene veldig separate og beveger seg raskt, så disse kreftene har ingen større forekomst. Men i væsker, hvis partikler har mer samhold, er disse kreftene mer intense, og i faste stoffer er det enda større.
Kinetisk teori om gasser
Den korpuskulære modellen ble først brukt på gasser, ettersom den er den enkleste tilstanden av aggregerings- og samhørighetskrefter mellom molekylene er minimale. I tillegg var egenskapene til gassene godt kjent gjennom de eksperimentelle verkene til den engelske kjemikeren Robert Boyle og den franske Joseph Gay Lussac og Jacques Charles.
Den ideelle gassmodellen, den enkleste, vurderer det:
- Størrelsen på partiklene er mye mindre enn avstandene mellom dem, og at dimensjonene til beholderen. De er spesifikke masser, det vil si mangler dimensjoner og opptar ikke et volum.
- Partiklene er i permanent agitasjon, og er deres bevegelse bare av oversettelse.
- Noen ganger kolliderer partiklene elastisk, med hverandre og med veggene i beholderen. I helt elastiske støt bevares kinetisk energi.
- Det er ingen attraktive krefter mellom molekyler. De eneste interaksjonene skyldes kollisjoner som oppstår fra tid til annen og i veldig kort tid. Av resten virker hvert molekyl uavhengig av de andre.
- Hvis det ikke er noen eksterne krefter som virker på partikkelsystemet, er disse fordelt jevnt gjennom hele volumet som er tilgjengelige.
Selv om dette er den enkleste modellen, forklarer oppførselen til enhver tett gass ved høye temperaturer og lavt trykk. Forskere har utviklet andre bedre justerte modeller til oppførselen til virkelige gasser, for dette anser de det:
- Molekylene har en målbar størrelse.
- Intermolekylære krefter blir ikke kansellert.
Ideell gassligning
Takket være postulatene til den ideelle gassen, oppstår et uttrykk som relaterer de makroskopiske størrelsene på trykket P, volum V og temperatur T:
P ∙ V = NRT
Hvor n er antall mol gass og r er den universelle konstanten av gasser, hvis verdi i internasjonale systemenheter er 8.314 J/mol ∙ K.
Kinetisk energi og temperatur
I en ideell gass manifesterer all indre energi seg som kinetisk energi. Den gjennomsnittlige kinetiske energien til N -molekylene til en ideell gass er direkte proporsjonal med temperaturen i Kelvin:
Korpuskulær modell i væsker og faste stoffer
Egentlig kan all materie finnes i de tre enkleste tilstandene: for eksempel gass, væske eller fast stoff, avhengig av trykk og temperatur. Det er andre aggregeringstilstander som plasma, men ikke nær jordoverflaten.
Disse tilstandene skyldes måten intermolekylære attraksjonskrefter virker, som er kortfattet, det vil si at de ikke handler hvis avstanden mellom molekyler er veldig stor og partiklene beveger seg i høy hastighet. Dette er tilfelle av gasser, som tillater fenomenet diffusjon raskere. Dette forklarer at ved å avdekke aromaen sprer aromaen seg raskt.
Kan tjene deg: Hva er det magnetiske øyeblikket?På den annen side, når partiklene er nærmere og bevegelsen deres er tregere, som i væsker og faste stoffer, har disse intermolekylære kreftene muligheten til å utøve sin handling.
Når en gass passerer til flytende tilstand, avtar volumet, fordi avstanden mellom partiklene avtar, og enda mer når den blir solid.
Materie i flytende tilstand
I flytende tilstand er ikke intermolekylære krefter foraktelige, men virker i mindre skala enn i fast tilstand. Partiklene danner små grupper, som går i oppløsning og omgrupper kontinuerlig, og gir mobiliteten til materialet, selv om de opprettholder et fast volum.
Denne mobiliteten gjør at væsker kan tilpasse seg formen på beholderen og gir dem muligheten til å strømme, i tillegg til å kunne blande lettere å blande. Diffusjonen kan oppstå, men saktere enn i gasser.
Likevel har partiklene nok samhold slik at væsken forblir ukomprimerbar i et bredt temperaturområde.
Overflatespenning
På overflaten av væsken er det molekyler som ubalanserte intermolekylære krefter virker, noe som gir opphav til en nettokraft opp. Denne nettokraften minimeres når væsken har lavest mulig overflate.
Takket være denne kraften, kan pinner, klipp, insekter og andre små gjenstander å holde seg på den stille overflaten av vannet uten å synke.
 I dette bildet kan et molekyl sees på overflaten av væsken, som en nettokraft virker opp, noe som lar insektet gå på vannet uten å synke
I dette bildet kan et molekyl sees på overflaten av væsken, som en nettokraft virker opp, noe som lar insektet gå på vannet uten å synke Solidstatssak
I fast tilstand er partiklene veldig nær hverandre, og de intermolekylære kreftene gjør at partiklene forblir i faste posisjoner. Selv om de kan vibrere rundt denne posisjonen, tar faste stoffer en definert form og opprettholder sitt konstante volum.
Når varmen strømmer, øker amplituden til vibrasjonsbevegelsen og temperaturen øker. Dette fører til at kroppsdimensjonene øker med temperatur, et fenomen som kalles Termisk utvidelse. Hvis nok varmen strømmer, kan faststoffet til og med gå til væskefasen.


