Postradusjonelle modifikasjoner
- 4633
- 462
- Prof. Joakim Johansen
Hva er post -translasjonelle modifikasjoner?
Post -overtranslasjonelle modifikasjoner er reversible eller irreversible modifikasjoner eller kjemiske endringer.
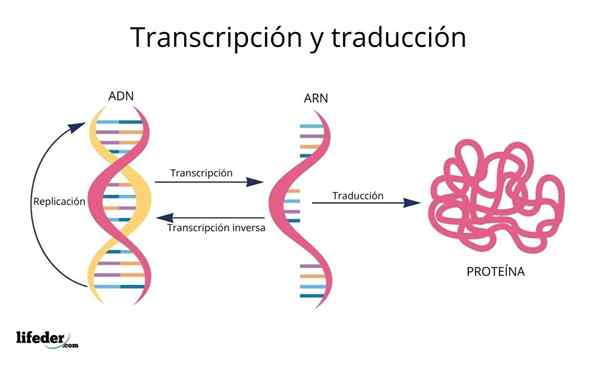
Oversettelsen er resultatet av "lesing og tolkning" av informasjonen i genene som finnes i den eukaryote kjernen (forekommer også i prokaryoter).
Gensettet til en celle -genom- Det er her instruksjonene skal produsere alle strukturelle proteiner og enzymene som finnes i det cellulære interiøret, som prosessene og vitale funksjoner til hver celle er avhengige.
Genene er dannet av DNA (deoksyribonukleinsyre), som er et makromolekyl dannet av to komplementære kjeder av en polymer sammensatt av 4 typer forskjellige molekyler kalt Nitrogenbaser, Nemlig: Adenina, Timina, Guanina og cytosin.
DNA er da en slags alfabet Med informasjon som blir lest og oversatt.
Før oversettelse er informasjon i DNA først transkribert Innenfor kjernen til et annet veldig likt molekyl, RNA (ribonukleinsyre), i form av kalt molekyler Messenger RNA, som senere blir transportert til cytosol.
RNA er veldig likt DNA, men dannes av en enkelt kjede sammensatt av adenin, uracil, guanin og cytosin nitrogenbaser.
Messenger -RNA -ene, avledet fra de genetiske kodende proteinsekvensene, er deretter "lest" og deres sekvens er oversatt i peptidsekvensene av celleproteiner ved hjelp av ribosomer og andre RNA -molekyler kjent som Overfør RNA det, som navnet tilsier, De overfører aminosyrene som passer for proteinet som er syntetisert.
Rekkefølgen som disse aminosyrene tilsettes i de begynnende proteiner er diktert av sekvensen av genene som koder dem, det vil si av nitrogenbaser i DNA -sekvensen i DNA -sekvensen.
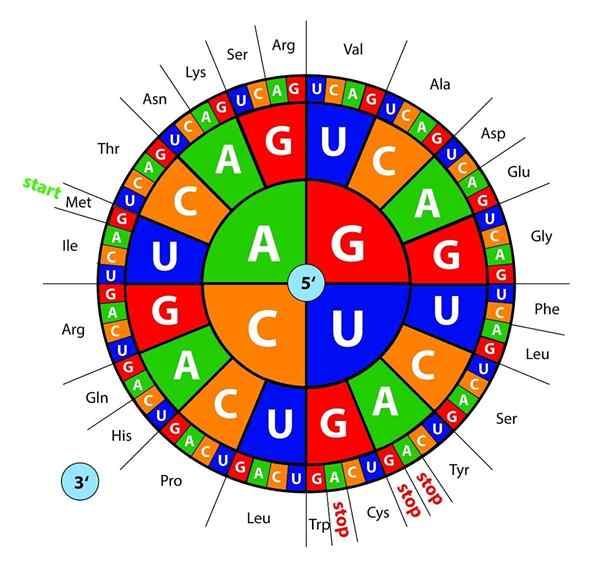
DNA -baser, transkribert som RNA, blir "lest" av ribosomer i trios eller tripletter som kalles kodoner, hver og en av dem koder for en av de 20 aminosyrene som proteiner dannes med; Her er dette genetisk kode tolkes til å introdusere, i riktig rekkefølge, en aminosyre samtidig.
Post -translasjonelle modifikasjoner
De fleste av de fysisk -kjemiske og funksjonelle egenskapene til hvert protein avhenger hovedsakelig av informasjonen som er kodet i DNA.
Imidlertid klarer cellene å øke mangfoldet av proteiner betydelig gjennom post -translasjonelle modifikasjoner, som ikke er noe mer enn kjemiske modifikasjoner - mediert av enzymer - som lider noen proteiner etter deres oversettelse.
Det kan tjene deg: oksidase glukose: egenskaper, struktur, funksjonerDerfor kan ikke egenskapene til noen proteiner utledes utelukkende fra aminosyresekvensen som stammer fra genetisk informasjon.
Disse modifikasjonene forekommer vanligvis på aminosyreavfall som gjør.
More than 500 post -translational modifications have been described, but of these the best known and studied are phosphorylation, the formation of disulfide bridges, methylation, acetylation, hydroxylation, glycosylation, prenilation, ubiquitination and carboxylation.
Postradusjonell modifiseringsprosess
Post -translasjonelle modifikasjoner, som vi har kommentert, er kjemiske modifikasjoner som lider av eukaryote celleproteiner etter at syntesen deres har skjedd, det vil si deres oversettelse.
De har generelt å gjøre med tilsetning av kjemiske grupper og/eller modifisering av aminosyreavfall som utgjør proteiner, men noen viktige modifikasjoner har også å gjøre med etablering av bindinger mellom aminosyrer med samme protein, eller også med eliminering av aminosyrer o peptider tegn ved kutt eller Clivajes proteolytisk.
Disse modifikasjonene er mulig takket være tilstedeværelsen av visse spesialiserte cellulære enzymer, og i tillegg små størrede energisubstrater - er de ikke spontane reaksjoner - som for eksempel:
- ATP (adenosin 5-fosfat)
- Acetylkoenzym A (Acetyl Co-A)
- NAD+ (5'-nicinamid 5'-difosfat adenosin)
- S-ADENOSIL METIONINA (SAM)
- 5'-difosfat uracil N-Acetyl glukosamin (UDP-GRCNAC)
- Uracil 5'-glukosedifosfat (UDP-glukose)
- Blant andre
Noen av de viktigste post -translasjonelle modifikasjonene fungerer som brytere (Suiches) Molekylær som aktiverer eller deaktiverer de enzymatiske funksjonene til noen proteiner, regulerer deres cellefunksjon eller til og med dens intracellulære plassering.
For eksempel syntetiseres mange proteiner som tilhører intracellulære organeller i cytosolen med N-O-terminale ender som tilsvarer Signalesekvenser, som gjenkjennes av andre proteiner som er ansvarlige for å lede dem til passende rom, og på vei fjernes disse signalene vanligvis fra proteinstrukturen.
Et annet veldig slående eksempel på post -translasjonelle modifikasjoner som har å gjøre med proteolytisk clivaje er det av visse hormoner og enzymer med proteaseaktivitet, som syntetiseres som inaktive proteiner som trenger proteolytisk fjerning av noen av sine aminosyrer for å bli deres aktive former.
Konjugerte proteiner
Selv om de ikke alltid blir anerkjent som sådan, er andre veldig viktige post -translasjonelle modifikasjoner de som involverer dannelse av proteiner hvis struktur er sammensatt av en eller flere peptidkjeder assosiert med en ikke -proteinforbindelse, enten gjennom kovalente bindinger eller svakere interaksjoner og forbigående.
Generelt er disse proteinene klassifisert i henhold til identiteten til den ikke -proteinfraksjonen og krever slike porsjoner for å utføre sine funksjoner.
Det kan tjene deg: blodagarDisse brøkene eller delene er kjent som Protesegrupper Og et godt eksempel på disse proteinene er hemoglobin, som er koblet med en hemo -gruppe.
Endoplasmatisk retikulum i aksjon
Mange post -translasjonelle modifikasjoner begynner inne i det grove endoplasmatiske retikulum, der tilknyttede ribosomer oversetter proteiner når de settes inn i membranen til denne organellen.
I det endoplasmatiske retikulumet skaffer mange proteiner sin endelige strukturelle konformasjon: signalsekvensene deres fjernes, brettes i riktig form, disulfur broer dannes, sukkerholdige grupper blir lagt til osv.
Typer post -translasjonelle modifikasjoner
Mer enn 500 typer forskjellige post -translasjonelle modifikasjoner er beskrevet i eukaryote celler; Følgende listegrupper noen av de mest studerte:
-
Fosforylering
Overføring av en eller flere fosfatgrupper fra molekyler med høy energi, for eksempel ATP, mot aminosyrehydroksylgruppen som serin, treonin og tyrosin; Det er formidlet av enzymene til gruppen av Menn proteiner (Disse fosfatene fjernes av enzymer fosfataser).
Det er viktig i en rekke cellehendelser som inndeling, signaloverføring, karbohydratmetabolisme, cellevekst og cellesyklusens fremgang, blant andre.
-
Sulfonering
Dette er tilsetningen av en gruppe -SO3H (sulfonisk) utelukkende i avfallet av tyrosinaminosyren og er typisk for transmembraale proteiner eller proteiner som skilles ut. Det katalyseres av tyrosil-sulfotransferase-enzymer.
Det er en viktig prosess for funksjonen av mange membranereseptorer, for visse typer intracellulær skilting, etc.
-
Disulfur Bridge -formasjon mellom cysteiner
Denne prosessen skjer mellom cysteinrester og er en av de viktigste post -translasjonelle modifikasjonene fra det strukturelle synspunktet. Disulfidbroene er etablert i organeller som Golgi -komplekset og endoplasmatisk retikulum, som har oksiderende miljøer.
Dette innlegget -Translasjonell modifisering har å gjøre med etablering av en viss strukturell konfigurasjon som vanligvis er veldig viktig for aktiviteten til mange enzymer.
-
Metylering
Det består av tilsetning av metylgrupper i aminosyrer som lysin, arginin, histidin, glutamin og asparagin (N-metylering), så som aspartat og glutamat (O-metylering) eller som cystein (S-metylering).
Det oppstår takket være den katalytiske virkningen av enzymer kjent som N-, O- eller S-metyltransferaser. Proteinmetylering er essensielt for regulering av genetisk transkripsjon ved histonproteinnivå, men har også en lavere rolle i signaloverføring.
-
Acetylering
Det innebærer tilsetning av acetylgrupper til lysinrester av noen proteiner. Det katalyseres av acetyltransferase -enzymer og har også veldig viktige funksjoner fra synspunktet av reguleringen av genetisk ekspresjon (på histonproteiner, som binder seg til DNA).
-
Hydroksylering
Det forekommer vanligvis i prolin-, lysin- og asparaginavfall og katalyseres av jernavhengige hydroksylase-enzymer. De resulterende aminosyrene, hydroksyprol og hydroksilisin er veldig viktige for modning av noen proteiner (inkludert kollagen) og for noen antibiotiske og soppdrepende forbindelser (hydroxiasparagin).
-
Glykosylering
Denne modifiseringen er en veldig viktig prosess for eukaryote celler. Det forekommer først og fremst på serin- og asparaginavfall, men det kan også forekomme på hydroksyproliner eller hydroksilisiner.
Det kan tjene deg: evolusjonisme: opprinnelse, darwin, sosial, lineær og kulturell evolusjonismeDen består av tilsetning av karbohydratmolekyler til proteinstrukturen og katalyseres av glykosyltransferase -enzymer og forekommer spesielt i utskillelsesproteiner og hos de som finnes på celleoverflaten.
-
Prenila
Den består av overføring av isaprenilos (lipid) -grupper til noen proteiner. Enzymene som er ansvarlig er spesifikke transfraser for hver gruppe.
Denne prosessen er viktig for forankring av noe protein til cellemembraner, men forekommer også under signaltransduksjon, etc.
-
Ubiquitinering
Dette er den kovalente tilsetningen av ett eller flere kopier av peptidet kjent som Ubiquitin. Dette tillegget merke Til proteiner for nedbrytning i et proteinkompleks kjent som 26S -proteosomet.
Det representerer et veldig effektivt intracellulært reguleringssystem, og er ansvarlig for å ødelegge proteiner gjennom en ATP-avhengig rute og med deltakelse av tre forskjellige enzymer samtaler E1, E2 og E3.
Eksempler
Fosforylering og glysilasjon er to ekstremt viktige post -translasjonelle modifikasjoner for celleliv. Ikke bare fordi de kontrollerer mange prosesser relatert til kommunikasjon og cellesyklus, men også fordi de er veldig vanlige blant eukaryoter.
P53 -protein er for eksempel et protein kjent som "tumorundertrykkende" som brukes under noen kreftbehandlinger. Aktiveringen avhenger av virkningen av forskjellige kinaseproteiner som er ansvarlige for fosforylering av dens N-terminale ende.
På den annen side inneholder den eukaryote celleoverflaten et stort antall glykoproteiner (post -translasjonsmodifiserte proteiner ved tilsetning av karbohydrater).
Mange av disse proteinene har viktige funksjoner i immungjenkjenning, i cellemigrasjon, i anerkjennelse og union til reseptorer, blant andre.
Referanser
- Alberts, f., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2015). Essensiell cellebiologi. Garland Science.
- Cox, m. M., & Nelson, D. L. (2008). Lehninger prinsipper for biokjemi. Wh Freeman.
- Garrett, r. H., & Grisham, C. M. (1999). Biokjemi.
- Grønt, k. D., & Garneau-Tesodikova, S. (2010). Posttranslasjonell modifisering av proteiner.
- Walsh, c. T., Garneau - -Sodikova, S., & Gatto jr, g. J. (2005). Post -Translational Protein Modifications: The Chemistry of Proteome Diversifications. Angewandte Chemie International Edition, 44 (45), 7342-7372.