Molaritetskonsentrasjon, enheter, beregning, øvelser
- 4154
- 965
- Prof. Theodor Gran
De Molaritet Det er konsentrasjonen av en løsning uttrykt i føflekker fra løsningen per liter løsning. Det er forkortet som M og uttrykker en sammenheng mellom massen av oppløsningen og volumet av løsningen (M/V); Selv om dette forholdet på en tradisjonell måte uttrykkes som volumvekt.
Én mol er antall atomer eller molekyler inneholdt i atom- eller molekylvekten; Det kommer til uttrykk i gram/mol. En føflekk tilsvarer 6,02 · 1023 Atomer eller molekyler, kjent som Avogadro -nummeret.
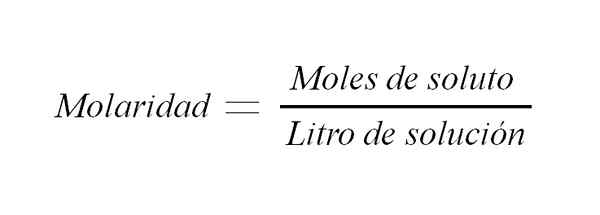 Molaritetsformel. Kilde: Gabriel Bolívar.
Molaritetsformel. Kilde: Gabriel Bolívar. Det er andre måter å uttrykke forholdet mellom massen til et løst stoff og volumet, inkludert: prosentandel forholdet mellom massen til løst stoffet og volumet av løsningen og normaliteten. Sistnevnte uttrykkes som antall ekvivalenter med en løsning per liter løsning.
I mellomtiden uttrykker moleality, som er definert som antall føflekker per kilo løsningsmiddel, vanligvis vann, en sammenheng mellom massen til oppløsningen og massen til løsningsmidlet (m/m).
Ekspresjonsformen for konsentrasjonen av en løsning i deler per million (ppm), uttrykker en sammenheng mellom en del av oppløsningen og en million deler av løsningen, vanligvis brukt til å uttrykke et masse-Masa-forhold (m/m). Men du kan uttrykke et massevolum-forhold (m/v).
Molar konsentrasjon, i tillegg til å uttrykke seg i føflekker per liter, kan uttrykkes som millimoler/liter (millimolar løsning); mikromoler/ liter (mikromolar løsning); etc.
Molaritetsproblemer kan løses ved bruk av en analytisk metode og ved bruk av "regelen om tre". Valget av en metode vil avhenge av evnen til å bruke en av metodene.
[TOC]
Mola konsentrasjon
Brukes til å uttrykke konsentrasjonen av et løst stoff i en viss løsning av løsning.
M = N/V (1)
Der M er lik molaritet, er N antall føflekker, og v volumet av løsningen. Så, molariteten til en løsning er antall mol løsesett etter volum av oppløsning uttrykt i liter.
På den annen side er antall føflekker
n = m / pm (2)
Å være m massen av det oppløste oppløsningen og PM dens molmasse.
Kan tjene deg: aldehydosErstatning (2) i (1):
M = (m / pm) / v
Enheter
Enheten i det internasjonale systemet for molskonsentrasjon er mol/m3. Dette tilsvarer en millimolar løsning, fordi en m3 tilsvarer 1.000 liter. I grenene til kjemi og biologi uttrykkes mola konsentrasjon vanligvis som mol/l. Denne enheten kommer til uttrykk med M (kapital).
En løsning av en mol/l, tilsvarer en m; En 10 løsning-3 føflekker/l, tilsvarer 1 mm (millimolar); og en 10 -løsning-6 Mol/l, tilsvarer 1 um (mikromolar).
Hvordan beregne molaritet?
Det er praktisk å bruke uttrykkene som er angitt ovenfor, fordi dette sikrer at resultatet av å anvende formelen vil gi i mol/liter, som er definisjonen av molskonsentrasjon.
Så for å beregne molariteten til en løsning er det nødvendig å uttrykke konsentrasjonen av oppløsningen i g / l. Finn deretter ut molekylvekten til oppløsningen (g / mol) og finn kvotienten mellom konsentrasjon og molekylvekt. Resultatet som er oppnådd er molariteten uttrykt i mol / liter.
Gå fra molaritet til molealitet
Et nødvendig faktum å gå fra molaritet til molealitet er å kjenne tettheten av løsningen. Dette gjør det mulig å kjenne massen til løsningen, et essensielt krav for beregning av molealitet.
Første skritt
Først må du gå fra molskonsentrasjon til gram/liter. For å gjøre dette, er det nok å multiplisere molariteten til løsningen med molekylvekten til løst stoffet.
Gram/liter av løsten = molaritet (mol/liter) · molekylvekt på løst stoffet (gram/mol).
Dette gjør det mulig å oppnå massen av løsningen i 1 l.
Andre trinn
Da er det nødvendig å beregne massen av løsningen. For å gjøre dette brukes tettheten av det samme. Vanligvis uttrykkes tettheten i gram/kubisk centimeter eller milliliter.
Løsningsmasse (g) = løsningsvolum (ml) · tetthet (g/ml)
Tredje trinn
Å få løsningsmiddelmassen. Ettersom massen av løsningen er lik massen av løsningen pluss massen av løsningsmidlet, er det nok å trekke fra løsningen (trinn 2) massen til løstet (trinn for å oppnå massen til den siste. 1).
Det kan tjene deg: perklorisk oksid (CL2O7)Fjerde trinn
Til slutt må du passere massen av løsningen (g) av løsningen til massen av løst stoff som tilsvarer 1.000 g eller 1 kg løsningsmiddel. For å gjøre dette, ville det være nok å lage en regel med tre enkel eller annen ekvivalent matematisk drift.
Femte trinn
Del G av løst stoff/1000 g løsningsmiddel mellom molekylvekten til løst stoffet (g/mol) for å oppnå moralen i løsningen.
Numerisk eksempel
En 3 m glukoseløsning (180 g/mol molekylvekt) har en tetthet på 1,15 g/ml. Beregn molealiteten til denne løsningen.
Vi beregner først gram av glukose oppløst i en liter løsning:
g/l = 3 mol/l · 180 g/mol
= 540 g/l
Deretter beregner vi massen av løsningen fra dens tetthet:
g av løsningen (masse) = 1.000 ml · 1,15 g/ml
= 1.150 g
Oppløsningsmiddelmassen er gitt av forskjell:
Løsemiddelmasse = løsningsmasse - Løst masse
= 1.150 g - 540 g
= 610 g
Men 610 g er ikke 1000 g løsningsmiddel som å bestemme definisjonen av moleality. Derfor blir hvor mange gram glukose beregnes oppløses i 1000 g løsningsmiddel:
Løsningsmasse = 540 g Løst · (1.000 g løsningsmiddel / 610 g løsningsmiddel)
= 885,25 g
Og til slutt beregnes molealiteten ved å returnere gramene til føflekker:
Molalitet = (885,25 g løst / 180 g / mol)
= 4,92 mol løst / kg løsningsmiddel
= 4,92 m
Problemer løst
Oppgave 1
Hvor mye cupric sulfat vil være nødvendig for å fremstille 500 ml av en 0,4 m løsning? Uttrykke resultatet i gram. Molekylvekt av kuprisk sulfat (CUSO4): 160 g/mol.
Vi bestemmer først føflekkene som må oppløses i en slik løsning:
M = N/ V
n = m · v
n = (0,4 mol/l) · 0,5 l
= 0,2 føflekker
Å vite da antall mol kuprisk sulfat kan oppnås sin masse
N = m/pm
m = n · molekylvekt
M = 0,2 mol · 160 g/mol
= 32 g CUSO4
Det vil si 32 gram av dette saltet må oppløses i 500 ml løsningsmiddel.
Oppgave 2
Hvilket volum av en løsning er nødvendig for å løse opp 0,4 mol oppløst, har den en konsentrasjon på 0,25 m?
Volumet av løsningen oppnås fra molaritetsbegrepet
Kan tjene deg: samario: egenskaper, struktur, innhenting, brukM = N / V
V = n / m
V = 0,4 mol / (0,25 mol / l)
= 1,6 l
Det betyr at løsningen må ha et volum på 1,6 liter for å oppnå en slik konsentrasjon på 0,25 m.
Oppgave 3
En masse på 8 g natriumhydroksyd (NaOH) oppløses i 60 g av en løsning som har en tetthet på 1,6 g/ml. Hva vil være molariteten i løsningen? Molekylvekt av natriumhydroksyd: 40 g/mol.
Naohs føflekker må beregnes først:
N = m / pm
= 8 g natriumhydroksyd / (40 g / mol)
= 0,2 føflekker
Nå beregnes volumet på løsningen:
M = v · d
V = 60 g /(1,6 g /ml)
V = 37,5 ml
For å oppnå molaritet, må volumet av løsningen i liter plasseres:
V = 37,5 ml · 10-3 L / ml
= 0,0375 l
M = 0,2 mol / 0,0375 l
5.33 Mol / l
5,33 m
Oppgave 4
Beregn molariteten til en løsning av saltsyre (HCl) med en 1,25 g/ml tetthet og 35% konsentrasjon, uttrykt masse/masse. Molekylvekt av saltsyre: 36,5 g/mol.
Massen på 35% saltsyre bestemmes
M = v · d
m = 1.000 ml · 1,25 g/ml
= 1.250 g
Men ikke alt er HCl, men det er også vann:
HCl -masse = 1.250 g · (35/100)
= 437,5 g
Noe som er det samme som å si at det i en liter på 35% HCl -løsning er 437,5 gram HCl.
Deretter beregnes HCL -føflekker, for deretter å bestemme molaritet:
N = m / pm
n = (437,5 g/l)/(36,5 g/mol)
= 11,98 føflekker/l
Molaritet = 11,98 m
Oppgave 5
Beregn molariteten til en løsning som inneholder 5 g NaCl i 2 L -løsning. Molekylvekt av natriumklorid: 58,5 g/mol.
Mol/l NaCl kan oppnås i et enkelt trinn:
Molaritet = (5 g NaCl / 2 L -løsning) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol /l
Molaritet = 0,043 m
En annen prosedyre kan være:
G / l NaCl = 5 g / 2 l
= 2,5 g / l
Mol / l = (2,5 g / l) / (58,5 g / mol)
= 0,043 mol / l
= 0,043 m
Referanser
- Rodríguez, m. (2007). Kjemi. Salesiana redaksjon
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2019). Molaritet. Gjenopprettet fra: er.Wikipedia.org
- Atarés Huerta. (s.F.). Molaritet og molealitet. [PDF]. Gjenopprettet fra: Riunet.UPV.er
- Softchools. (2019). Molaritetsformel. Gjenopprettet fra: softschools.com
- « Spesielle forbindelser egenskaper, trening, bruk
- Vanskeligheter med å konsolidere et nasjonsprosjekt »

