Algebraisk balanseringsmetode (med eksempler)

- 4810
- 812
- Jonathan Moe
Han Algebraisk balansemetode Det brukes i kjemi for å matche antall atomer på begge sider av en kjemisk reaksjon. En kjemisk reaksjon skrevet riktig, må ha formlene for alle reagensene som deltar på venstre side og produktene, også med sine formler, på høyre side.
Men når du har en reaksjon, er antallet atomer i reagensformlene tilsvarer det av de respektive atomer i formlene til produktene ikke alltid gjør det ikke alltid.
 Figur 1. Den algebraiske balanseringsmetoden er et enkelt verktøy for å balansere kjemiske ligninger. Kilde: f. Zapata.
Figur 1. Den algebraiske balanseringsmetoden er et enkelt verktøy for å balansere kjemiske ligninger. Kilde: f. Zapata. Imidlertid er deigen bevart. La oss for eksempel se følgende reaksjon:
KCl3 → KCl + O2
Denne ligningen har en forbindelse som kalles kaliumklorat, som brytes ned ved oppvarming i kaliumklorid og gassoksygen. Men når vi ser nøye, merker vi at det i kloratmolekylet er 3 oksygenatomer, mens det til høyre bare er en gassoksygenmolekyl med 2 atomer.
Det som da gjøres er å multiplisere med en numerisk koeffisient til reagenset til venstre, slik at antallet atomer i alle de deltagende elementene er det samme før og etter reaksjonen.
Men ... hva er verdien av denne koeffisienten?
[TOC]
Måter å balansere ligninger på
I den forrige ligningen er det lett å bestemme passende koeffisienter ved inspeksjon. Hvis vi multipliserer med 2 til venstre, har vi 2 atomer av K, 2 av CL og 6 av O.
Derfor, til høyre, multipliserer vi kaliumklorid med 2 og o2 av 3:
2 Kclo3 → 2KCL + 3O2
Og nå kan vi se at regnskapet er riktig på begge sider av pilen og reaksjonen ble balansert. Merk at andre numeriske verdier også kan resultere i en balansert ligning, for eksempel:
Kan tjene deg: borsyre: kjemisk struktur, egenskaper, forberedelser, bruk4 Kclo3 → 4KCL + 6O2
Imidlertid bør settet med hele minimumstall som tilsvarer mengden atomer på begge sider alltid søkes.
Tallene som multipliserer hver formel kalles koeffisienter. Det er veldig viktig å merke seg at koeffisienter kan tildeles balanse, men abonnement må forbli som de vises i hver formel.
Koeffisienter kan heller ikke settes inn midt i formelen til hver forbindelse, siden den vil endre den.
Enkle ligninger som eksempel kan balanseres ved inspeksjon eller poengsum. For de som er litt mer komplekse er det en algebraisk metode med en serie enkle trinn og elementære aritmetiske operasjoner beskrevet nedenfor.
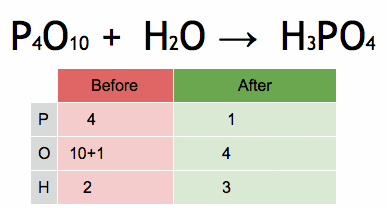 Figur 2. Animasjon som viser balansering av en kjemisk ligning for å oppnå fosforsyre. Kilde: Wikimedia Commons. EPHERT/CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)
Figur 2. Animasjon som viser balansering av en kjemisk ligning for å oppnå fosforsyre. Kilde: Wikimedia Commons. EPHERT/CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0) Trinn for algebraisk balansere en kjemisk ligning
Trinn 1
-Tilordne hvert molekyl en vilkårlig koeffisient, symbolisert med et brev. Tekster A, B, C, D .. ., om nødvendig etter behov.
Viktig: Husk at bare en koeffisient brukes av molekyl og aldri er ispedd midt i den, den er alltid plassert til venstre.
Steg 2
-Lag en liste over hvert deltakende element.
Trinn 3
-Plasser koeffisienten eller koeffisientene tildelt hver forbindelse til venstre og match de til høyre. Hvis det er abonnement, multipliserer de med koeffisienten for å finne det totale antallet atomer.
Og hvis noe element finnes i mer enn ett molekyl, tilsettes mengden atomer som er til stede på hver side. På denne måten delvise ligninger av hvert element.
Trinn 4
-En numerisk verdi er tilordnet en av koeffisientene. Vanligvis er denne numeriske verdien 1 og tilordnes bokstaven som vises flere ganger. Dette oppnår en enkel ligning som fungerer som utgangspunkt for å finne de andre koeffisientene.
Kan tjene deg: fortynningsfaktorTrinn 5
-Bestem verdien av følgende koeffisient med enkel aritmetikk og erstatt verdien i en annen ligning, for å heve en ny.
Trinn 6
-Gjenta forrige trinn for å erstatte verdier og opprette en ny ligning, til du finner alle koeffisientene.
Trinn 7
-Erstatte verdier som er bestemt således. Hvis disse verdiene er hele, må det verifiseres at ligningen ble balansert. Hvis de ikke var hel, multipliseres det med minimumsmultippelen av nevnerne, og balansen blir sjekket.
Da vil vi visualisere anvendelsen av disse trinnene i oppløsningen av noen eksempler.
Løste balanseringseksempler
Eksempel 1
Balanse følgende reaksjon om nødvendig, gjennom den algebraiske metoden:
N2ENTEN5 → n2ENTEN4 + ENTEN2
Løsning
Vi observerer at reaksjonen ikke er balansert, for selv om det er 2 nitrogenatomer på begge sider, med oksygen.
Da må vi følge trinnene som er beskrevet i forrige avsnitt:
-Vi skriver ligningen igjen og multipliser hvert molekyl med en annen koeffisient. Små bokstaver er valgt slik at de ikke blir forvekslet med elementene:
A⋅n2ENTEN5 → B⋅n2ENTEN4 + C⋅o2
-Nå lister vi opp hvert element og samsvarer med mengden av det elementet til venstre og høyre. Dette er de delvise ligningene for hvert element:
- A⋅n2 = B⋅n2
- A⋅o5 = B⋅o4 + C⋅o2
-Multipliserer koeffisienten og abonnementet får vi antall nitrogenatomer. Fra ligning 1 får vi:
2a = 2b
-Av ligning 2 har 5. plass oksygenatomer til venstre, mens til høyre er det 4b og 2 c:
5a = 4b + 2c
-Vi tildeler verdi 1 til koeffisient A, på denne måten:
A = 1
Dette valget er vilkårlig, det kan også velges først b = 1.
-Disse verdiene erstattes i ligning 2 for å bestemme verdien av C:
Det kan tjene deg: Cupric Oxide (CUO)5 = 4 + 2c
2C = 5-4 = 1
C = ½
-Vi erstatter koeffisientene i den opprinnelige ligningen, 1 er ikke nødvendig for å skrive den eksplisitt:
N2ENTEN5 → n2ENTEN4 + ½ o2
-Siden det er å foretrekke at koeffisientene er hel, multipliseres hele ligningen med det minste felles multiplum av nevnerne, som er 2 og 1:
m.c.m. (1.2) = 2
Ved å multiplisere venstre og høyre med 2 oppnås det:
2n2ENTEN5 → 2n2ENTEN4 + ENTEN2
Og vi teller antall atomer på begge sider, for å sjekke balansen:
- N til venstre: 4
- Eller igjen: 10
- N til høyre: 4
- Eller høyre: 8 + 2 = 10
Eksempel 2
Balansere følgende kjemiske reaksjon:
Nahco3 → Na2Co3 + H2Eller + co2
Løsning
Vi multipliserer hvert molekyl med en annen koeffisient:
A⋅ NAHCO3 → B⋅na2Co3 + C⋅H2O + D⋅CO2
Så foreslår vi regnskapsføringen av hvert element til høyre og til venstre for pilen. Det er totalt 4 elementer i reaksjonen: natrium Na; Hydrogen H; Bilbil og oksygen eller, alle må telles:
- A⋅na = b⋅na2
- A⋅H = C⋅H2
- A⋅c = b⋅c + d⋅c
- A⋅o3 = B⋅o3+C⋅o+d⋅o2
I henhold til hver balanse oppnås følgende ligninger:
1) A = 2b
2) A = 2C
3) A = B + D
4) A = 3B + C + 2D
Den mest gjentatte koeffisienten er til, Derfor tildeler vi verdien 1:
A = 1
Så:
1) A = 2B ⇒ B = ½
2) A = 2C ⇒ C = ½
3) A = B + D ⇒ D = A - B = 1 - ½ = ½
Vi erstatter koeffisientene i ligningen:
Nahco3 → ½. Na2Co3 + ½. H2O + ½.Co2
Vi multipliserer på begge sider av pilen med 2, siden det er den eneste nevneren som er til stede, for å eliminere brøkdelen:
2nahco3 → Na2Co3 + H2Eller + co2
Vi teller antall atomer som er til stede til venstre: 2 atomer av Na, H og C og 6 av O. Leseren kan bekrefte at hver av dem også er til stede til høyre i samme mengder.
Referanser
- Atkins, p. Prinsipper for kjemi: oppdagelsesveiene. Pan -American Medical Editorial. 3. utgave.
- Briceño, J. USB Chemistry Guide. Gjenopprettet fra: Gecousb.com.gå.
- Chang, R. 2013. Kjemi. 11va. Utgave. Mc Graw Hill Education.
- Løste øvelser. Algebraisk balansering. Hentet fra: Sumeltede øvelser.co.
- Simoza, l. Balansering av kjemiske ligninger. Gjenopprettet fra: Guao.org.
- « Døde ladningsegenskaper, beregning, eksempler
- Inka -arkitekturfunksjoner og enestående konstruksjoner »

