Redox Balance Method trinn, eksempler, øvelser
- 4274
- 86
- Prof. Theodor Gran
Han Redox Balancing Method Det er en som gjør det mulig å balansere de kjemiske ligningene av redoksreaksjoner, som ellers ville være hodepine. Her utveksler en eller flere arter elektroner; Den som donerer eller mister dem, kalles oksidantarter, mens den som aksepterer eller vinner dem, en reduktiv art.
I denne metoden er det viktig å kjenne oksidasjonsnumrene til disse artene, siden de avslører hvor mange elektroner som har fått eller tapt med MOL. Takket være dette er det mulig å balansere de elektriske ladningene ved å skrive i ligningene elektronene som om de var reaktanter eller produkter.
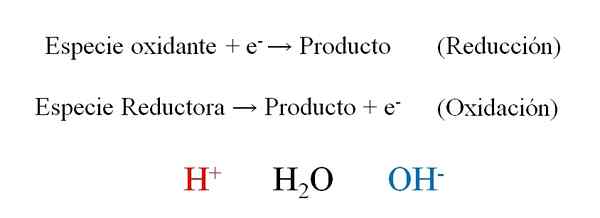
 Generelle semi -reaches av en redoksreaksjon med de tre hovedpersonene under deres balansering: H+, H2O og OH-. Kilde: Gabriel Bolívar.
Generelle semi -reaches av en redoksreaksjon med de tre hovedpersonene under deres balansering: H+, H2O og OH-. Kilde: Gabriel Bolívar. Det overordnede bildet viser hvordan elektroner effektivt, og- De er plassert som reagenser når den oksiderte arten vinner dem; Og som produkter når den reduserende arten mister dem. Merk at for å balansere denne typen ligninger er det nødvendig å mestre begrepene oksidasjon og oksidasjonstall.
Arten h+, H2Eller OH-, Avhengig av pH i reaksjonsmediet, tillater det redoksbalansering, så det er veldig vanlig å finne dem i øvelsene. Hvis mediet er syre, vender vi oss til H+; Men hvis tvert imot er mediet grunnleggende, bruker vi OH- For balansering.
Naturen til reaksjonen selv dikterer hva pH i mediet skal være. Det er grunnen til at selv om det kan balanseres ved å anta et syre eller basisk medium, vil den endelige balanserte ligningen indikere om ionene H er usannsynlige eller ikke egentlig+ Og åh-.
[TOC]
Trinn
- Generell
Kontroller oksidasjonsnumrene til reagensene og produktene
Anta at følgende kjemiske ligning:
Cu (S) + agno3(AC) → Cu (nei3)2 + Ag (er)
Dette tilsvarer en redoksreaksjon, der en endring i oksidasjonstallene til reagensene oppstår:
Cu0(S) + AG+NEI3(AC) → Cu2+(NEI3)2 + Ag (er)0
Identifiser oksiderende og reduktive arter
Den oksiderende arten får elektroner som oksideres av den reduserende arten. Derfor avtar oksidasjonsnummeret: det blir mindre positivt. I mellomtiden øker oksidasjonsnummeret til de reduserende artene, siden det mister elektroner: det blir mer positivt.
I den forrige reaksjonen blir kobberet oksidert, siden det passerer fra Cu0 til Cu2+; Og sølv reduseres, fordi det går fra AG+ En ag0. Kobber er den reduserende arten, og sølv oksidasjonsarten.
Skriv semi -reaksjoner og balansere atomer og belastninger
Identifisere hvilke arter som får eller mister elektroner, er redoks semi -reaksjoner skrevet for både reduksjonsreaksjonen og oksidasjon:
Cu0 → Cu2+
AG+ → Ag0
Kobber mister to elektroner, mens sølv vinner en. Vi plasserer elektronene i begge semi -reaksjoner:
Kan tjene deg: Kaliumfosfat (K3PO4): Struktur, egenskaper, brukCu0 → Cu2+ + 2e-
AG+ + og- → Ag0
Merk at belastningene forblir balansert i begge semi -reaksjoner; Men hvis de ble lagt til, ville bevaringsloven bli krenket: antall elektroner må være det samme i de to semi -reaksjonene. Derfor multipliseres den andre ligningen med 2 og de to ligningene er lagt til:
(Cu0 → Cu2+ + 2e-) x 1
(Ag+ + og- → Ag0) x 2
Cu0 + 2ag+ + 2e- → Cu2+ + 2ag0 + 2e-
Elektronene blir kansellert for å være på sidene av reagensene og produktene:
Cu0 + 2ag+ → Cu2+ + 2ag0
Dette er den globale ioniske ligningen.
Bytt ut koeffisienter for den ioniske ligningen i den generelle ligningen
Til slutt flytter de støkiometriske koeffisientene for den forrige ligningen til den første ligningen:
Cu (S) + 2agno3(AC) → Cu (nei3)2 + 2AG (S)
Merk at de 2 var plassert med Agno3 For i dette saltet er sølvet som AG+, Og det samme gjelder Cu (nei3)2. Hvis denne ligningen ikke er balansert på slutten, blir poengsummen gjort.
Ligningen som ble foreslått i de foregående trinnene kunne ha blitt balansert direkte av Tanteo. Imidlertid er det redoksreaksjoner som trenger et surt medium (h+) eller grunnleggende (åh-) skje. Når dette skjer, kan det ikke balanseres under forutsetning av at mediet er nøytralt; som det nettopp har blitt vist (den ble ikke lagt til eller h+ Og enten åh-).
På den annen side er det praktisk å vite at semi -reaksjonene skrev atomer, ioner eller forbindelser (for det meste oksider) der endringer i oksidasjonstall oppstår. Dette vil bli fremhevet i øvelsesseksjonen.
- Balansering i surt medium
Når mediet er syre, må du stoppe ved de to semi -reaksjonene. Denne gangen på balanseens tid ignorerer vi oksygen- og hydrogenatomer, og også elektroner. Elektroner vil balansere på slutten.
Deretter, på reaksjonssiden med mindre oksygenatomer, legger vi til vannmolekyler for å kompensere for det. På den andre siden balanserer vi hydrogenene med H -ioner+. Og til slutt legger vi til elektronene og fortsetter etter de generelle trinnene som allerede er utsatt.
- Balansering i grunnleggende medium
Når mediet er grunnleggende, er det på samme måte som i det sure miljøet med en liten forskjell: denne gangen på siden der det er mer oksygen, vil et vannmolekyler lik dette overflødige oksygen være lokalisert; Og på den andre siden, Oh -ioner- For å kompensere for hydrogener.
Til slutt blir elektronbalanse, de to semi -reaksjonene tilsatt, og koeffisientene til den globale ioniske ligningen i den generelle ligningen erstattes.
Kan tjene deg: Spredte systemer: Typer, egenskaper og eksemplerEksempler
Følgende redox -ligninger uten balanse og balansert fungerer som eksempler for å observere hvor mye endring etter å ha brukt denne balanseringsmetoden:
P4 + Clo- → Po43- + Cl- (uten balanse)
P4 + 10 Clo- + 6 timer2O → 4 PO43- + 10 cl- + 12 timer+ (Balansert halvsyre)
P4 + 10 Clo- + 12 Å- → 4 PO43- + 10 cl- + 6 timer2O (grunnleggende medium balansert)
Yo2 + Kno3 → i- + Kio3 + NEI3- (uten balanse)
3i2 + Kno3 + 3H2O → 5i- + Kio3 + NEI3- + 6H+ (Balansert halvsyre)
Cr2ENTEN27- + Hno2 → Cr3+ + NEI3- (uten balanse)
3hno2 + 5H+ + Cr2ENTEN27- → 3no3- +2cr3+ + 4H2O (balansert syrebalanse)
Øvelser
Oppgave 1
Balanse følgende ligning i grunnleggende medium:
Yo2 + Kno3 → i- + Kio3 + NEI3-
Generelle trinn
Vi starter med å skrive oksidasjonsnumrene til arten som vi mistenker har rustne eller redusert; I dette tilfellet, jodatomer:
Yo20 + Kno3 → i- + Ki5+ENTEN3 + NEI3-
Merk at jod oksiderer og samtidig reduseres, så vi fortsetter med å skrive de to respektive semi -reaksjoner:
Yo2 → i- (Reduksjon, for hver jeg- 1 elektron forbrukes)
Yo2 → io3- (Oksidasjon, for hver IO3- 5 elektroner frigjøres)
I oksidasjon semi -lys plasserer vi anionen io3-, og ikke til atomet av jod som jeg5+. Vi balanserer jodatomene:
Yo2 → 2i-
Yo2 → 23-
Balansering i grunnleggende medium
Nå fokuserer vi på å svinge i grunnleggende medium Semi -reaksjonen av oksidasjon, siden den har en oksygenert art. Vi legger til på siden av produktene samme antall vannmolekyler som oksygenatomer:
Yo2 → 23- + 6H2ENTEN
Og på venstre side balanserer vi hydrogenene med OH-:
Yo2 + 12OH- → 23- + 6H2ENTEN
Vi skriver de to semi -reaksjonene og legger til de manglende elektronene for å balansere de negative belastningene:
Yo2 + 2e- → 2i-
Yo2 + 12OH- → 23- + 6H2O + 10E-
Vi matchet begge elektronene tallene i begge semi -reaksjoner og legger dem til:
(Yo2 + 2e- → 2i-) x 10
(Yo2 + 12OH- → 23- + 6H2O + 10E-) x 2
12i2 + 24 Å- + 20E- → 20i- + 4. plass3- + 12H2O + 20E-
Elektronene blir kansellert og delt alle koeffisienter med fire for å forenkle den globale ioniske ligningen:
(12i2 + 24 Å- → 20i- + 4. plass3- + 12H2O) x ¼
3i2 + 6OH- → 5i- + Io3- + 3H2ENTEN
Og til slutt erstatter vi koeffisientene til den ioniske ligningen i den første ligningen:
3i2 + 6OH- + Kno3 → 5i- + Kio3 + NEI3- + 3H2ENTEN
Det kan tjene deg: ionisk kraft: enheter, hvordan beregne det, eksemplerLigningen er allerede balansert. Sammenlign dette resultatet med balansering i et syremedium med eksempel 2.
Oppgave 2
Balansere følgende ligning i surt medium:
Tro2ENTEN3 + CO → FE + CO2
Generelle trinn
Vi observerer oksidasjonsnummeret av jern og karbon for å vite hvilke av de to som har oksidert eller redusert:
Tro23+ENTEN3 + C2+O → tro0 + C4+ENTEN2
Jern er redusert, så det er oksidasjonsarten. I mellomtiden har karbon rusten, og oppfører seg som den reduserende arten. Semi -reaksjoner for oksidasjon og redisjon angående er:
Tro23+ENTEN3 → Tro0 (Reduksjon, for hver tro blir 3 elektroner konsumert)
CO → CO2 (Oksidasjon, for hver CO2 2 elektroner frigjøres)
Merk at vi skriver oksidet, tro2ENTEN3, Fordi det inneholder tro3+, I stedet for bare å plassere tro3+. Vi balanserer atomene som er nødvendige unntatt oksygen:
Tro2ENTEN3 → 2fe
CO → CO2
Og balansering utføres i syren i begge semi -reaksjoner, siden det er oksygenerte arter i mellom.
Balansering i surt medium
Vi legger vann til å balansere oksygen, og deretter h+ Å balansere hydrogener:
Tro2ENTEN3 → 2Fe + 3H2ENTEN
6H+ + Tro2ENTEN3 → 2Fe + 3H2ENTEN
CO + H2O → co2
CO + H2O → co2 + 2H+
Nå balanserer vi belastningene ved å plassere elektronene som er involvert i semi -reaksjoner:
6H+ + 6e- + Tro2ENTEN3 → 2Fe + 3H2ENTEN
CO + H2O → co2 + 2H+ + 2e-
Vi samsvarer med antall elektroner i begge semi -reaksjoner og legger dem til:
(6H+ + 6e- + Tro2ENTEN3 → 2Fe + 3H2O) x 2
(CO + H2O → co2 + 2H+ + 2e-) x 6
12 timer+ + 12e- + 2fe2ENTEN3 + 6CO + 6H2O → 4Fe + 6H2O + 6CO2 + 12H+ + 12e-
Vi avbryter elektroner, H -ioner+ Og vannmolekylene:
2fe2ENTEN3 + 6CO → 4Fe +6CO2
Men disse koeffisientene kan deles med to for å forenkle ligningen enda mer, med:
Tro2ENTEN3 + 3CO → 2Fe +3CO2
Dette spørsmålet oppstår: redoksbalansering for denne ligningen var nødvendig? Av Tanteo hadde det vært mye raskere. Dette viser at denne reaksjonen fortsetter om hverandre fra medium pH.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (22. september 2019). Hvordan balansere redoksreaksjoner. Gjenopprettet fra: Thoughtco.com
- Ann Nguyen & Luvleen Brar. (5. juni 2019). Redoksreaksjoner balanserer. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Quimitube. (2012). Oppgave 19: Justering av en redoksreaksjon i basisk medium med to oksidasjons semi -reaksjoner. Gjenopprettet fra: Quimitube.com
- Washington University i St. Louis. (s.F.). Øvingsproblemer: Redoksreaksjoner. Gjenopprettet fra: Kjemi.Wustl.Edu
- John Wiley & Sons. (2020). Hvordan balansere redoks ligninger. Gjenopprettet fra: dummies.com
- Rubén Darío eller. G. (2015). Balansering av kjemiske ligninger. Gjenopprettet fra: Lær i Linea.du.Edu.co
- « Ulikhet og sosiale bevegelser i Mexico (1950-1980)
- Mohr -metode grunnleggende, reaksjoner, prosedyre, bruker »

