Kobbernitrat (ii)
- 1808
- 312
- Theodor Anders Hopland
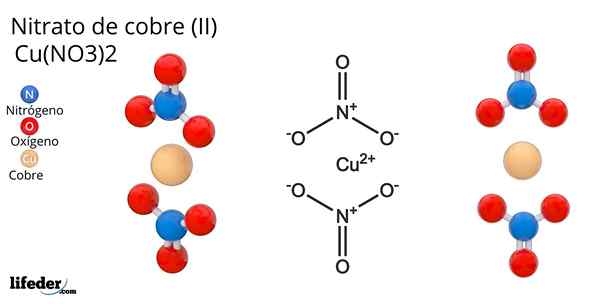
 Formel og struktur av kobbernitrat (ii)
Formel og struktur av kobbernitrat (ii) Han Kobbernitrat (Ii) eller Cupric nitrat, hvis kjemiske formel er Cu (nei3)2, Det er et strålende uorganisk salt og attraktive blågrønne farger. Det syntetiseres i industriell skala fra nedbrytningen av kobbermineraler, inkludert Gerhardita og Rouaita -mineraler.
Andre mer gjennomførbare metoder, når det gjelder råstoff og ønskede mengder salt, består av direkte reaksjoner med metallkobber og dets avledede forbindelser. Når kobber er i kontakt med en konsentrert løsning av salpetersyre (HNO3), oppstår en redoksreaksjon.
I denne reaksjonen er kobber oksidert og nitrogen redusert i henhold til følgende kjemiske ligning:
Cu (S) + 4hno3(conc) => cu (nei3)2(AC) + 2H2Eller (l) + 2no2(g)
Nitrogendioksid (nei2) er en brun og skadelig gass; Den resulterende vandige oppløsningen er blåaktig. Kobber kan danne Cuprous -ionet (Cu+), Cupric Ion (Cu2+) eller det minst vanlige ion Cu3+; Imidlertid er ikke cuprousionet foretrukket i vandige medier av mange elektroniske, energi og geometriske faktorer.
Standard reduksjonspotensial for CU+ (0,52V) er større enn for Cu2+ (0,34V), noe som betyr at Cu+ Det er mer ustabilt og har en tendens til å vinne et elektron for å bli CU (er). Dette elektrokjemi -tiltaket forklarer hvorfor det ikke er noen CUNO3 som et produkt av reaksjonen, eller i det minste i vann.
[TOC]
Kobbernitrategenskaper
 Kobbernitratutseende (II) Triohydrat
Kobbernitratutseende (II) Triohydrat Kobbernitrat er anhydrid (tørr) eller hydrert med forskjellige proporsjoner vann. Anhydrid er en blå væske, men etter å ha koordinert med vannmolekyler - i stand til å danne hydrogenbroer - krystalliserer hvordan Cu (nei3)2· 3H2O o cu (nei3)2· 6H2ENTEN. Dette er de tre mest tilgjengelige saltformene i markedet.
Det kan tjene deg: Helmholtz gratis energi: enheter, hvordan den beregnes, løste øvelserMolekylvekten for tørt salt er 187,6 g/mol, og tilfører denne verdien 18 g/mol for hvert vannmolekyl inkorporert i saltet. Densiteten er lik 3,05 g/ml, og den avtar med hvert innebygd vannmolekyl: 2,32 g/ml for tri-hydrert salt, og 2,07 g/ml for heksa-hydrert salt. Det har ikke noe kokepunkt, men sublima.
De tre formene for kobbernitrat er svært oppløselige i vann, ammoniakk, dioksan og etanol. Smeltepunktene går ned når et annet molekyl tilsettes den eksterne koordineringsfæren av kobber; Fusjonen blir fulgt av den termiske nedbrytningen av kobbernitrat, og produserer skadelige gasser av NO2:
2 cu (nei3)2(S) => 2 Cuo (S) + 4 Nei2(g)+ eller2(g)
Den kjemiske ligningen ovenfor er for anhydridsalt; For hydratiserte salter vil vanndamp også forekomme på høyre side av ligningen.
Elektronisk konfigurasjon
Elektronisk konfigurasjon for ion Cu2+ Det er [ar] 3d9, Presentere paramagnetisme (elektronet i 3D -orbitalen9 er forsvunnet).
Ettersom kobber er en overgangsmetall av den fjerde perioden av det periodiske bordet, og etter å ha mistet to av sine Valencia -elektroner per handling av HNO3, Den har fortsatt 4s og 4p orbitaler tilgjengelig for å danne kovalente bindinger. Enda mer, Cu2+ Du kan bruke to av dens ytterste 4D -orbitaler for å kunne koordinere opptil seks molekyler.
Anionene nr3- De er flate, og for Cu2+ Du kan koordinere med dem må ha en SP -hybridisering3d2 Det lar deg adoptere en oktaedrisk geometri; Dette forhindrer at anioner ikke3- være "truffet" blant dem.
Det kan tjene deg: Kondensert formel: Hva er og eksempler (metan, etan, glukose ...)Dette oppnås av CU2+, plassere dem i et firkantet fly rundt seg selv. Den resulterende konfigurasjonen for atomet til Cu i salt er: [AR] 3D94s24p6.
Kjemisk struktur
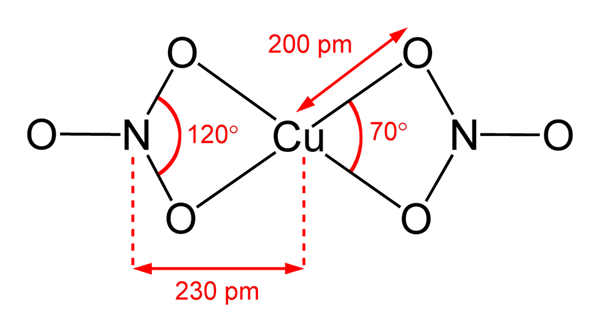 Kobbernitratstruktur (ii)
Kobbernitratstruktur (ii) I det overlegne bildet er et isolert molekyl av Cu representert (nei3)2 I en gassfase. Nitrat anion oksygenatomer koordineres direkte med kobbersenteret (intern koordinasjonssfære), og danner fire Cu-O-bindinger.
Den har en firkantet plan molekylær geometri. Flyet trekkes av de røde kulene i toppunktene og kobberfæren i sentrum. Interaksjoner med gassformig fase er veldig svake på grunn av elektrostatiske frastøtninger mellom grupper ikke3-.
Imidlertid danner kobbersentrene i fast fase metallkoblinger -cu-cu-, og skaper polymerkoblingskjeder.
Vannmolekyler kan danne hydrogenbroer med grupper ikke3-, Og disse vil tilby hydrogenbroer for andre vannmolekyler, og så videre til en vannfære rundt Cu (nei3)2.
På denne sfæren kan den ha 1 til 6 ytre naboer; Derfor er saltet lett hydrert for å generere hydratiserte tri- og heksasalter.
Salt dannes fra et ion Cu2+ og to ioner nei3-, Å gi en karakteristisk krystallinitet av ioniske forbindelser (Ortorrombic for Anhydrid Salt, Rhomboédica for hydratiserte salter). Koblingene er imidlertid av større kovalent karakter.
Bruk/applikasjoner
For de fascinerende fargene på kobbernitrat finner dette saltet bruk som tilsetningsstoff i keramikk, på metalliske overflater, i noe fyrverkeri og også i tekstilindustrien som en mordant.
Kan tjene deg: entalpiDet er en god kilde til ionisk for mange reaksjoner, spesielt de der det katalyserer organiske reaksjoner. Den finner også lignende bruksområder som andre nitrater, enten som soppdrepende, ugressmiddel eller som konserveringsmiddel for tre.
En annen av dens viktigste og mest nye bruksområder er i syntesen av CUO -katalysatorer, eller materialer med lysfølsomme egenskaper.
Det brukes også som et klassisk reagens i undervisningslaboratorier for å vise reaksjoner inne i volaiske celler.
Risiko
- Det er et sterkt oksidasjonsmiddel, skadelig for det marine, irriterende, giftige og etsende økosystemet. Det er viktig å unngå all fysisk kontakt direkte med reagenset.
- Det er ikke brannfarlig.
- Den dekomponerer ved høye temperaturer som frigjør irriterende gasser, blant disse2.
- I den menneskelige organismen kan det forårsake kronisk skade på de sentrale kardiovaskulære og nervesystemene.
- Kan forårsake irritasjoner i mage -tarmkanalen.
- Å være et nitrat, i kroppen blir det nitritt. Nitritt hever herjinger i nivåene av oksygen i blodet og i det kardiovaskulære systemet.
Referanser
- Dag, r., & Underwood, a. Kvantitativ analytisk kjemi (Femte utg.). Pearson Prentice Hall, P-810.
- Mel Science. (2015-2017). Mel Science. Gjenopprettet fra Mel Science: Melscience.com
- ResearchGate GmbH. (2008-2018). ResearchGate. Gjenopprettet fra ResearchGate: ResearchGate.nett
- Forskningslabratorie. Forskningslabratorie. Gjenopprettet fra Science Lab: Sciencelab.com
- Whitten, Davis, Peck og Stanley. (2008). Kjemi (Åttende utg.). P-321. Cengage Learning.
- Wikipedia. Wikipedia. Wikipedia ble frisk: i.Wikipedia.org

