Sølvnitrat (AGNO3) struktur, egenskaper, bruksområder, toksisitet

- 3287
- 761
- Jonathan Carlsen
Han Sølvnitrat Det er et uorganisk salt hvis kjemiske formel er agno3. Av alle sølvsalter er det den mest økonomiske og den som presenterer en relativ stabilitet mot sollys, så det har en tendens til å dekomponere. Det er den oppløselige og predilekt sølvkilden i hvert undervisnings- eller forskningslaboratorium.
I undervisningen brukes vandige sølvnitratoppløsninger for å lære sølvkloridutfellingsreaksjoner. På samme måte settes disse løsningene i kontakt med metallkobber for å finne sted en Rédox -reaksjon, der metallsølvet utfeller midt i den dannede oppløsningen av kobbernitratet, Cu (nei3)2.
 Sølvnitratprøvebeholder. Kilde: w. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Sølvnitratprøvebeholder. Kilde: w. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) I det øvre bildet vises en flaske med sølvnitrat. Det kan holdes utsatt for lys uten en snart mørkere krystaller, produktet av utseendet til sølvoksid.
Etter de alkymiske skikker, og de antibakterielle egenskapene til metall sølv, har sølvnitrat blitt brukt til å desinfisere og cauterisere sår. For dette formålet brukes imidlertid veldig fortynnede vandige oppløsninger, eller dets faste blandet med kaliumnitrat påført av spissen av trestenger.
[TOC]
Sølvnitratstruktur
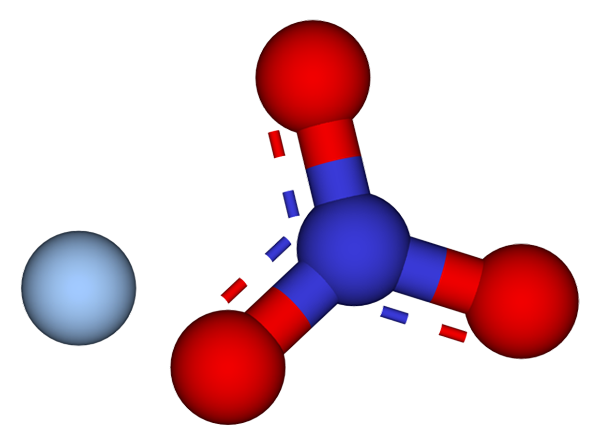 Ioner som utgjør sølvnitratkrystaller. Kilde: CCOIL/CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Ioner som utgjør sølvnitratkrystaller. Kilde: CCOIL/CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) I det øvre bildet vises Ag -ionene+ og ikke3- av sølvnitrat, som er representert med en modell av kuler og barer. Agno -formelen3 indikerer den støkiometriske andelen av dette saltet: for hver kation ag+ Det er ikke en anion3- samhandle med ham elektrostatisk.
Det kan tjene deg: Svovel: Historie, egenskaper, struktur, innhenting, brukAnion nr3- (av røde og blålige kuler) har en trigonal flat geometri, med den negative belastningen som demokker mellom de tre oksygenatomene. Derfor foregår elektrostatiske interaksjoner mellom de to ionene spesifikt mellom kation AG+ og et oksygenatom i anionen gjør det ikke3- (Ag+-ELLER IKKE2-).
På denne måten hver AG+ ender opp med å koordinere eller omgir tre nei3- tilstøtende i samme plan eller krystallografisk lag. Gruppering av disse planene ender opp med å definere en krystall hvis struktur er Ortorrombic.
Forberedelse
Sølvnitrat tilberedes ved å angripe et brent metall sølvstykke med salpetersyre, enten det er kaldt eller varmt konsentrert:
3 ag + 4 hno3 (utvannet) → 3 agno3 + 2 h2O +nei
Ag + 2 HNO3 (konsentrert) → agno3 + H2O +nei2
Legg merke til dannelsen av gasser nei og ikke2, som er giftig, og tvinger denne reaksjonen som ikke skal utføres utenfor en avtrekksklokke.
Fysiske og kjemiske egenskaper
Fysisk utseende
Fargeløs krystallinsk fast, toalett, men veldig bitter smak.
Molmasse
169.872 g/mol
Smeltepunkt
209,7 ºC
Kokepunkt
440 ºC. Ved denne temperaturen lider imidlertid en termisk nedbrytning, der metallsølv oppstår:
2 agno3(l) → 2 ag (er) + o2 (g) + 2 nei2 (g)
Det er ingen agno -damper3, I det minste ikke under terrestriske forhold.
Løselighet
Agno3 Det er en utrolig oppløselig vannbesparelse, med en løselighet på 256 g/ 100 ml ved 25 ° C. Det er også løselig i andre polare løsningsmidler som ammoniakk, eddiksyre, aceton, eter og glyserol.
Tetthet
4,35 g/cm3 ved 24 ºC (omgivelsestemperatur)
Kan tjene deg: destillert vann3,97 g/cm3 ved 210 ºC (bare ved smeltepunktet)
Stabilitet
Agno3 Det er et stabilt stoff når det er riktig lagret. Det blir ikke betent ved noen temperatur, selv om det kan brytes ned ved å frigjøre nitrogenoksider giftige røyk.
På den annen side, selv om sølvnitrat ikke er brannfarlig, er det et kraftig oksidasjonsmiddel som når du kommer i kontakt med organisk materiale og en varmekilde, er i stand til å utløse en eksoterm og eksplosiv reaksjon.
I tillegg til dette, skal dette saltet ikke bli utsatt for mye tid til sollys, siden krystaller er mørklagt på grunn av dannelsen av sølvoksyd.
Sølvnitrat bruker
Utfellende og analytisk middel
I forrige seksjon ble omtale av den utrolige løseligheten til Agno gjort3 I vann. Dette innebærer at Ag -ioner+ De vil oppløses uten problemer og vil være tilgjengelige for å samhandle med vandig mediumion, for eksempel halogenidanioner (x = f-, Cl-, Br- og jeg-).
Sølv som ag+, Og etter tilsetning av HNO3 Fortynnet, presipiterer fluoridene, klorider, bromider og jodider til stede, som består av hvite eller gulaktige faste stoffer:
AG+(Ac) +x-(AC) → AGX (er)
Denne teknikken er veldig tilbakevendende for å oppnå halogenuros, og brukes også i en rekke kvantitative analysemetoder.
Tollens reagens
Agno3 Det spiller også en analytisk rolle i organisk kjemi, ettersom det er hovedreagenset, ved siden av ammoniakk, for fremstilling av Tollens Reagent. Dette reagenset brukes i kvalitative studier som tillater å bestemme tilstedeværelsen av aldehyder og ketoner i en problemprøve.
Syntese
Agno3 Det er en utmerket oppløselig sølvionskilde. Dette, i tillegg til den relative og lave kostnaden, gjør det til et forespurt reagens for utallige organiske og uorganiske synteser.
Det kan tjene deg: Gibbs Gratis energi: enheter, hvordan den beregnes, løste øvelserUansett reaksjon, hvis du trenger AG -ioner+, Så det er ganske sannsynlig at kjemikalier tyr til agno3.
Medisin
Agno3 Han hadde mye popularitet innen medisin før utseendet til moderne antibiotika. I dag brukes det imidlertid fortsatt til spesifikke tilfeller, ettersom det har vaksin- og antibakterielle egenskaper.
Vanligvis er den blandet med KNO3 På spissen av trestenger, slik at den utelukkende er reservert for aktuell bruk. I denne forstand har det tjent for behandling av vorter, sår, infiserte negler, nasal munnsår og blødning. Agno -blandingen3-Kno3 Cauteriza huden ødelegger skadet vev og bakterier.
Agno -bakteriedrepende virkningen3 Det har også blitt brukt i vannrensing.
Toksisitet og bivirkninger
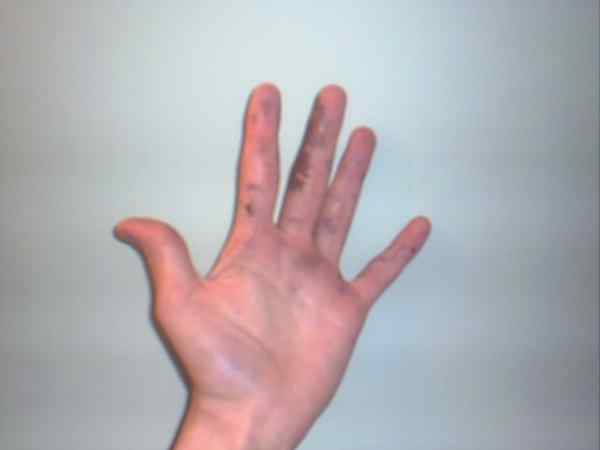 Sølvnitrat kan forårsake forbrenninger som vises av deres lilla eller mørke flekker. Kilde: Jane of Baden på engelsk Wikipedia / Public Domain
Sølvnitrat kan forårsake forbrenninger som vises av deres lilla eller mørke flekker. Kilde: Jane of Baden på engelsk Wikipedia / Public Domain Selv om sølvnitrat er en stabil lønn og ikke representerer for mange risikoer, er det et svært kaustisk fast stoff, hvis inntak kan forårsake alvorlig gastrointestinal skade.
Det er grunnen til at manipulasjonen med hansker anbefales. Det kan brenne huden, og i noen tilfeller, mørkere den til den vender lilla, tilstand eller sykdom kjent som Argiria.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Sølvnitrat. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Sølvnitrat. PubChem -database., CID = 24470. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Elsevier f.V. (2020). Sølvnitrat. Scientedirect. Hentet fra: Scientedirect.com
- University of Iowa. (2020). Sølvnitratbruk og toksisitet. Gjenopprettet fra: Medisin.Uiowa.Edu
- P.F. Lindley & p. Woodward. (1966). An X-Ray Research of Silver Nitrat: En unik metallnitratstruktur. Journal of the Chemical Society A: Uorganisk, fysisk, teoretisk.
- Lucy Bell Young. (2020). Hva er medisinsk bruk av sølvnitrat. Reagenskjemikalier. Gjenopprettet fra: kjemikalier.co.Storbritannia
- « Piperidinstruktur, syntese, derivater, reaksjoner
- C ++ historie, egenskaper, datatyper, eksempler »

