Bly nitratkonstruksjon, egenskaper, innhenting, bruker

- 3749
- 711
- Prof. Theodor Gran
Han blynitrat o Blynitrat (II) er en uorganisk forbindelse dannet av blyelementer (PB), nitrogen (N) og oksygen (O). Bly blir funnet som ion Pb2+ Og nitrogen og oksygen danner nitrationet3-.
Den kjemiske formelen er PB (nei3)2. Det er et hvitt krystallinsk fast stoff som er veldig løselig i vann, der det danner Pb -ioner2+ og ikke3-. Det er også kjent som Plumbose Nitrat fordi bly er i sin laveste oksidasjonstilstand.
 Solid blynitrat. Ondřej Mangl / Pub Domain. Kilde: Wikimedia Commons.
Solid blynitrat. Ondřej Mangl / Pub Domain. Kilde: Wikimedia Commons. Det har sterkt oksidasjonsegenskaper, så det brukes i applikasjoner der denne egenskapen er nødvendig, for eksempel ved fremstilling av forskjellige organiske forbindelser og som et laboratorireagens.
Tidligere ble det mye brukt til å tilberede blybaserte farger, der det også fungerte som en fikser av fargene i vevet. Denne applikasjonen ble forlatt på grunn av ledetoksisitet.
Det har blitt brukt i metallurgisk industri på forskjellige måter, og nylig har nytten blitt funnet å danne seg sammen med andre forbindelser, materialer med høye lysabsorpsjonskapasiteter og transformasjon av dette i elektrisitet.
Imidlertid er det et farlig stoff fordi det kan favorisere branngenerering. Det er også giftig for mennesker, dyr og planter, så det skal aldri kastes i miljøet.
[TOC]
Struktur
Det er en ionisk forbindelse dannet av en PB -kation2+ og to anioner nei3-. I nitratanionen er oksygen arrangert symmetrisk rundt nitrogen og alternativ dobbeltbinding med dette.
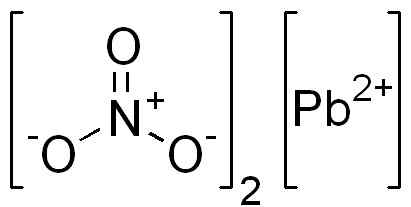 PB -struktur (nei3)2. Edgar181 / pub domene. Kilde: Wikimedia Commons.
PB -struktur (nei3)2. Edgar181 / pub domene. Kilde: Wikimedia Commons. 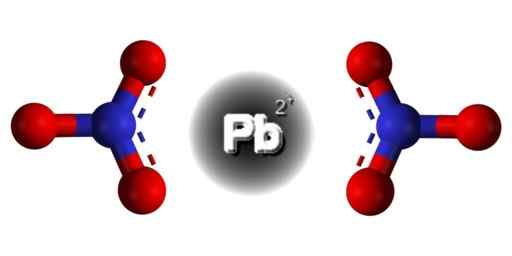 Romlig struktur av PB (nei3)2. Grå = bly; blå = nitrogen; Rød = oksygen. Claudio Pistilli/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Romlig struktur av PB (nei3)2. Grå = bly; blå = nitrogen; Rød = oksygen. Claudio Pistilli/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Bly i denne forbindelsen har følgende elektroniske konfigurasjon:
[Xe] 4F14 5d10 6s2 6p0, der det observeres at det har mistet de to elektronene i det siste laget.
Kan tjene deg: hva er det mest elektronegative elementet og hvorfor?Nomenklatur
- Blynitrat
- Blynitrat (ii)
- Plumboso nitrat
- Bly dinitrate
Egenskaper
Fysisk tilstand
Hvit eller fargeløs krystallinsk faststoff. Kubikkkrystaller.
Molekylær vekt
331 g/mol
Smeltepunkt
470 ºC. I følge noen kilder dekomponerer det ved denne temperaturen.
Tetthet
4,53 g/cm3
Løselighet
Veldig løselig i vann: 59,7 g/100 ml vann ved 25 ° C. Litt løselig i etanol. Uoppløselig i salpetersyre (HNO3) konsentrert.
Ph
En vandig løsning med 20% PB (nei3)2 Den har en pH på 3,0-4,0.
Kjemiske egenskaper
Er et oksidasjonsmiddel. Reagerer voldsomt med brennbare materialer og reduksjonsmidler.
Det er ikke drivstoff, men kan akselerere forbrenning av materialer som er. Hvis du varmer opp til nedbrytningen avgir giftige nitrogenoksydgasser:
2 PB (nei3)2 + Varme → 2 PBO + 4 nei2↑ + o2↑
Når du oppløses i vann, blir det ionisert:
PB (nei3)2 + H2O → Pb2+ + 2 nei3-
Å skaffe
Det kan utarbeides ved å reagere metallisk bly, blymonoksid (PBO) eller bly karbonat3 Med salpetersyre. Det er praktisk å bruke syreoverskudd for å forhindre grunnleggende nitrater.
PBO + 2 HNO3 (konsentrert) → PB (nei3)2↓+ H2ENTEN
applikasjoner
I organisk
Den oksidasjonskapasitet har påføring i fremstilling av forskjellige forbindelser.
Det har blitt brukt til å syntetisere calixarenos, som er organiske forbindelser hvis molekyl har formen som en kurv som gjør det mulig å huse andre stoffer avhengig av bruken som vil bli gitt til den.
Det tjener til å skaffe isotiocianates (R-CS) fra aminer (R-NH2).
Det brukes i industriell skala for å fremstille benzaldehyd oksidasjonsbenchilo klorid. Det fungerer også som en katalysator for forestring av organiske forbindelser, for eksempel for å oppnå polyestere.
I kjemisk analyse
Det brukes som et reagens i bestemmelsen av aluminium og bly i mineraler og bergarter.
I farging av tekstilfibre
Noen kromfargestoffer krever bruk av PB (nei3)2 for å oppnå. For eksempel, for å farge bomullsgul, er det dekket med blynitrat og behandles med natriumsulfat for å produsere blysulfat.
Kan tjene deg: tilsvarende vektDeretter brukes en fortynnet løsning av natriumdikromat for å danne blykromat (PBCRO4) Det er et gult pigment.
 For en tid siden ble gule stoffer farget med pigmenter hvis utgangspunkt var PB (nei3)2. Dette gjøres ikke ved blymidoksisitet. Forfatter: 3D -animasjonsproduksjonsselskap. Kilde: Pixabay.
For en tid siden ble gule stoffer farget med pigmenter hvis utgangspunkt var PB (nei3)2. Dette gjøres ikke ved blymidoksisitet. Forfatter: 3D -animasjonsproduksjonsselskap. Kilde: Pixabay. Imidlertid har blypigmentene for deres toksisitet i dag blitt stoppet med å bruke.
Det fungerer også som en mordant å fikse fargestoffene under fargen eller utskriften av andre typer fiber.
I Medina Veterinary
Det ble tidligere brukt som et kaustisk middel i behandlingen av Chancros eller Gangrenas hos hester.
I metallindustrien
Blynitrat brukes i elektrolytisk raffinering av bly, som et middel for å favorisere flotasjonen i fjerning av titan av visse leire, gjør det mulig å gjenvinne edle metaller av cyanidløsninger og brukes i PBO -elektrode2 på nikkelanoder.
I solceller
Det har blitt brukt i form av vandig løsning for å lage solceller basert på Perovskita, et titanoksydmineral.
Det syntetiserte materialet er et organometallisk eller pervskita av blyjodid som har fanget forskernes oppmerksomhet, siden det har en høy lysabsorpsjonskapasitet og en stor diffusjonslengde på belastningsbærerne.
Disse egenskapene gjør det til en utmerket kandidat for solcelleanordninger, det vil si at de gjør lys til elektrisk strøm.
 Mikrofotografi av strukturen til unavskita av blyhalogenid tatt med fluorescensmikroskop. Furava/cc av (https: // creativecommons.Org/lisenser/av/4.0). Kilde: Wikimedia Commons.
Mikrofotografi av strukturen til unavskita av blyhalogenid tatt med fluorescensmikroskop. Furava/cc av (https: // creativecommons.Org/lisenser/av/4.0). Kilde: Wikimedia Commons. Andre apper
Han (PBNO3)2 Det har også blitt brukt:
- I produksjonen av kamper, visse eksplosiver og pyrotekniske materialer,
- I fotografering som et sensibiliserende middel for å dekke papiret i fototermografi,
- I tekstilindustrien for å forbedre Rayon og stabilisere nylon,
- I eliminering av gnagere.
 Blynitrat har blitt brukt til å produsere fyrverkeri eller pyroteknisk materiale. Forfatter: Free-Goos. Kilde: Pixabay.
Blynitrat har blitt brukt til å produsere fyrverkeri eller pyroteknisk materiale. Forfatter: Free-Goos. Kilde: Pixabay. Risiko
Brann og eksplosjon
Selv om det ikke er en drivstoffforbindelse, hvis den blir utsatt for brann eller varme, kan den eksplodere, og genererer giftige nitrogenoksider.
Å være et sterkt oksidasjonsmiddel Det er en fare for at en brann genereres hvis den kommer i kontakt med organiske materialer.
Til helse
Produserer øyeirritasjon, luftveis- og fordøyelseskanal. Det er giftig ved innånding og inntak. De vanligste symptomene på forgiftning av denne forbindelsen er gastrointestinal, kolikk, forstoppelse og svakhet som blant annet kan bli lammelse av noen muskler.
Inntaket kan også forårsake smerter, kramper, depresjon, koma og død.
For det naturlige miljøet
Det er giftig for akvatiske og landorganismer, i tillegg er skadene deres vedvarende og bioakkumula i levende vesener, derfor regnes det som en farlig forurensende og bør ikke kastes til miljøet.
Hvis det ved en tilfeldighet blir sølt i vann, bør det nøytraliseres med kalsiumoksyd (CaO), kalsiumkarbonat (Caco3) eller natriumbikarbonat (NAHCO3).
Det er bekreftet at det er kreftfremkallende for dyr og muligens for mennesket.
Referanser
- ELLER.S. National Library of Medicine. (2019). Bly (ii) nitrat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Hsih, t.OG. et al. (2015). Effektiv posvskite solcelle produsert ved bruk av en vandig blynitratforløper. Chem Commun (Endre). 2015 4. september; 51 (68): 13294-7. NCBI kom seg.NLM.NIH.Gov.
- Vratny, f. og Gugliotta, f. (1963). Themal dekomponering av blynitrat. J. Inorg. NUKL. Chem., 1963, vol. 25, s. 1129-1132. Gjenopprettet fra Scientedirect.com.
- Chakraborty, J.N. (2014). Farging med mineralfarger. I midler og praksis i fargelegging av tekstiler. Gjenopprettet fra Scientedirect.com.
- Kumari, h. og Atwood, J. (2017). Calixarenes i solid tilstand. I referanse moduler i kjemi, molekylærvitenskap og kjemisk ingeniørarbeid. Gjenopprettet fra Scientedirect.com.
- Jeffery, s.G. og Hutchison, D. (1981). Aluminium. I Chemical Methods of Rock Analysis (Third Edition). Gjenopprettet fra Scientedirect.com
- Sandler, s.R. og Karo, w. (1992). Cyanater, isocyanater, tiocyanater og isotiocyanater. I kildebok for avanserte organiske laboratoriepreparater. Gjenopprettet fra Scientedirect.com.
- Smith, s.W.G. et al. (1969). Aromatiske halogenforbindelser. I aromatisk kjemi. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Wikimedia Foundation (2020). Bly (ii) nitrat. Innhentet fra.Wikipedia.org.
- Shinde, d.V. et al. (2017). Forbedret effekt og stabilitet av en vandig bly-nitratbasert organometalllisk perovskite solcellecelle. ACS Appl. Mater. 2017 grensesnitt, 9, 14023-14030. Gjenopprettet fra puber.ACS.org.
- « Fenoler eller fenolforbindelser egenskaper, typer, applikasjoner
- Blyacetatstruktur, egenskaper, innhenting, bruk »

