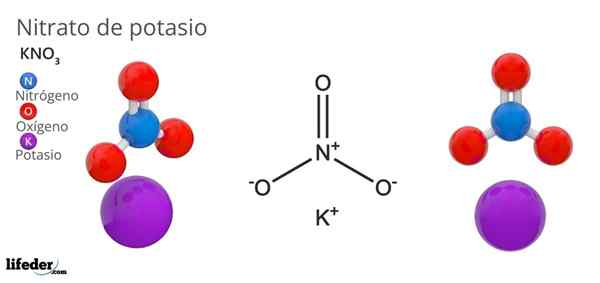
Kaliumnitrat (KNO3)
- 3115
- 992
- Magnus Sander Berntsen
Hva er kaliumnitrat?
Han kaliumnitrat Det er et ternært salt sammensatt av kalium, alkalisk metall og nitratoksoanion. Den kjemiske formelen er KNO3, Noe som betyr at for hver k ion+, Det er ingen ion3-- samspill med dette. Derfor er det et ionisk salt og utgjør en av de alkaliske nitratene (lino3, Eldre bror3, Rbno3...).
Kno3 Det er et sterkt oksidasjonsmiddel på grunn av tilstedeværelsen av nitratanion. Det vil si at det fungerer som en reserve av faste nitrationer, i motsetning til, i motsetning til andre svært oppløselige salter i vann eller veldig hygroskopisk. Mange av egenskapene og bruken av denne forbindelsen skyldes nitratanionen, i stedet for kaliumkationen.
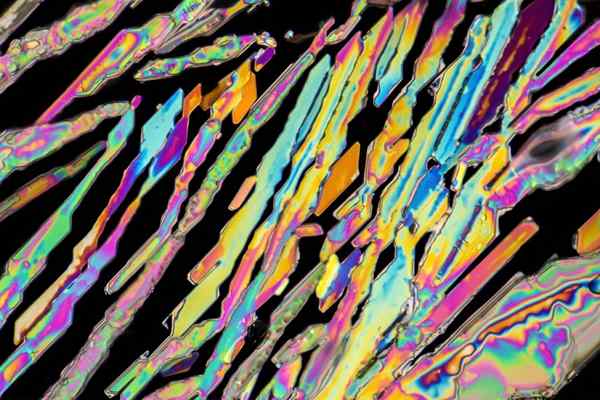 Kaliumnitratkrystaller
Kaliumnitratkrystaller I det øvre bildet er noen krystaller av KNO illustrert3 med nålformer. Den naturlige kilden til Kno3 er saltpeter, kjent som navnene Saltpeter enten Ballong, på engelsk. Dette elementet er også kjent som Potassa Nitrat eller Nitro Mineral.
Det ligger i tørre eller ørkenområder, samt utstrømning av de kavernøse veggene. Nok en viktig kilde til KNO3 Det er guano, ekskrement av dyr som bor i tørre miljøer.
Kjemisk struktur av kaliumnitrat
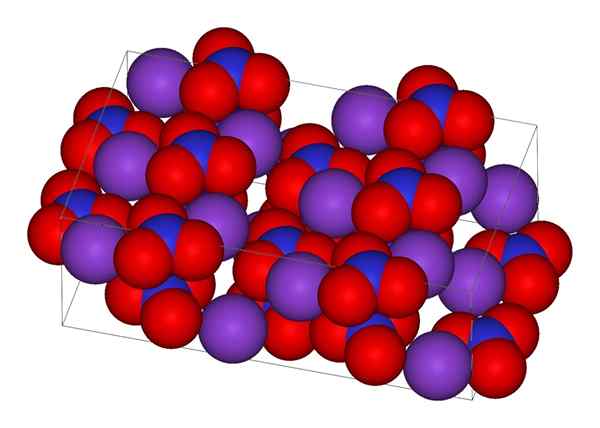 Krystallinsk struktur av kaliumnitrat
Krystallinsk struktur av kaliumnitrat I det øvre bildet er den krystallinske strukturen til KNO representert3. Lilla kuler tilsvarer k -ioner+, Mens røde og blå er henholdsvis oksygen- og nitrogenatomer. Den krystallinske strukturen er ortorrombisk ved romtemperatur.
Nion geometri nr3- Det er det av et trigonalt plan, med oksygenatomene i toppunktene til trekanten, og nitrogenatomet i sentrum. Den presenterer en positiv formell belastning i nitrogenatom, og to negative formelle belastninger i to oksygenatomer (1-2 = (-1)).
Kan tjene deg: enkelt mikroskopDisse to negative anklagene av nei3- De flytter mellom de tre oksygenatomene, og opprettholder alltid den positive belastningen i nitrogen. Som en konsekvens av de ovennevnte kioner-+ av krystallen unngår de å være rett over eller under nitrogenet til anionene ikke3-.
Faktisk demonstrerer bildet hvordan K -ioner+ De er omgitt av oksygenatomer, røde kuler. Avslutningsvis er disse interaksjonene ansvarlige for krystallinske arrangementer.
Andre krystallinske faser
Variabler som trykk og temperatur kan endre disse ordningene og forårsake forskjellige strukturfaser for KNO3 (Faser I, II og III). For eksempel er fase II av bildet, mens fase I (med trigonal krystallinsk struktur) dannes når krystallene blir oppvarmet opp til 129 ºC.
Fase III er et overgangs faststoff som oppnås fra avkjøling av fase I, og noen studier har vist at det viser noen viktige fysiske egenskaper, for eksempel ferroelektrisitet. I denne fasen danner krystallen kaliumlag og nitrater, muligens følsomme for elektrostatiske frastøtninger mellom ioner.
I lagene i fase III anioner nei3- De mister litt av planariteten (trekanten kurver litt) for å tillate denne ordningen, som før noen mekanisk forstyrrelse blir strukturen i fase II.
Kaliumnitrat bruker/applikasjoner
Salt er av stor betydning, siden det brukes i en rekke menneskers aktiviteter, som manifesterer seg i industri, landbruk, mat osv. Disse bruksområdene inkluderer følgende:
- Matbevaring, spesielt kjøtt. Til tross for mistanken om at det griper inn i dannelsen av nitrosamin (kreftfremkallende middel) brukes fremdeles i charcuterie.
- Gjødsel, fordi kaliumnitrat gir to av de tre plantene makronæringsstoffer: nitrogen og kalium. Sammen med fosfor er dette elementet nødvendig for utvikling av planter. Det vil si at det er en viktig og håndterbar reserve av disse næringsstoffene.
- Akselererer forbrenning, å kunne produsere eksplosjoner hvis det brennbare materialet er omfattende eller hvis det er fint delt (større overflateareal, større reaktivitet). I tillegg er det en av hovedkomponentene i krutt.
- Letter fjerningen av berøringen av de tale trærne. Nitrat forsyner nitrogenet som er nødvendig for sopp å ødelegge tre av stubber.
- Det griper inn i reduksjon av tannfølsomhet gjennom dens inkorporering i tannleger, noe som øker beskyttelsen av smertefulle sensasjoner av tannen produsert av kulde, varme, syre, søtsaker eller kontakt.
- Griper inn som en hypotensor i reguleringen av blodtrykk hos mennesker. Denne effekten vil bli gitt eller henger sammen med en endring i utskillelse av natrium. Den anbefalte dosen i behandlingen er 40-80 meq/kaliumdag. I denne forbindelse påpekes det at kaliumnitrat ville ha vanndrivende handling.
Syntese
Det meste av nitratet produseres i gruvene i ørkenene i Chile. Det kan syntetiseres ved flere reaksjoner:
NH4NEI3 (AC) +KOH (AC) => NH3 (AC) +KNO3 (AC)+H2Eller (l)
Kaliumnitrat nøytraliserer salpetersyre med kaliumhydroksyd i en svært eksoterm reaksjon.
KOH (AC) +HNO3(Conc) => Kno3 (AC) +H2Eller (l)
I industriell skala produseres kaliumnitrat ved en dobbel forskyvningsreaksjon.
Eldre bror3 (Ac) +KCl (Ac) => NaCl (AC) +KNO3 (AC)
Hovedkilden til KCL er fra Silvina Mineral, og ikke andre mineraler som Carnalite eller Cainite, som også er sammensatt av ionisk magnesium.
Fysiske og kjemiske egenskaper
Kaliumnitrat i fast tilstand presenteres som en hvit eller i form av ortorombiske strukturkrystaller ved omgivelsestemperatur, og trigonal ved 129 ºC. Den har en molekylvekt på 101.1032 g/mol, den er toalett og har en saltlinjektsmak.
Det er en veldig oppløselig forbindelse i vann (316-320 g/liter vann, ved 20 ° C), på grunn av dens ioniske natur og enkel vannmolekyler for å løse k ion k+.
Dens tetthet er 2,1 g/cm3 ved 25 ºC. Dette betyr at det er omtrent to ganger tett enn vann.
Smeltepunktene (334 ºC) og kokende (400 ºC) er en indikasjon på de ioniske bindinger mellom k+ og ikke3-. Imidlertid er de lave sammenlignet med andre salter, fordi krystallinsk retikulær energi er lavere for monovalente ioner (det vil si med belastninger ± 1), og har heller ikke veldig like størrelser.
Kan tjene deg: pH -indikatorerDen dekomponerer ved en temperatur nær kokepunktet (400 ° C) for å produsere kalium og molekylært oksygen:
Kno3(S) => Kno2(S) + eller2(g)
Referanser
- Pubchem. (2018). Kaliumnitrat. Gjenopprettet fra Pubchem.NCBI.NLM.Nik.Gov
- Krystall. (2009). Vekst og enkeltkrystallforfining av fase-III kaliumnitrat, KNO3. B65, 659-663.
- Marni Wolfe. (3. oktober 2017). Kaliumnitratrisiko. Livestrong kom seg.com
- Amethyst Galleries, Inc. (1995-2014). Mineral niter. Gallerier kom seg.com