Ingen metaller historie, egenskaper, grupper, bruker

- 4098
- 702
- Oliver Christiansen
De Ingen metaller De er en gruppe elementer som er plassert på høyre side av det periodiske bordet, med unntak av hydrogen som er lokalisert i gruppe 1 (AI), sammen med alkaliske metaller. Hvis du vil vite hva de er, må du se på øverste høyre hjørne av P -blokken.
Ikke -metale atomer er relativt små og deres ytre elektroniske lag har et forhøyet antall elektroner. Blant de ikke -metalliske elementene kan faste stoffer, væsker og gasser finnes; Selv om de stort sett er i en gassformig tilstand, beriker flere av dem atmosfæren.
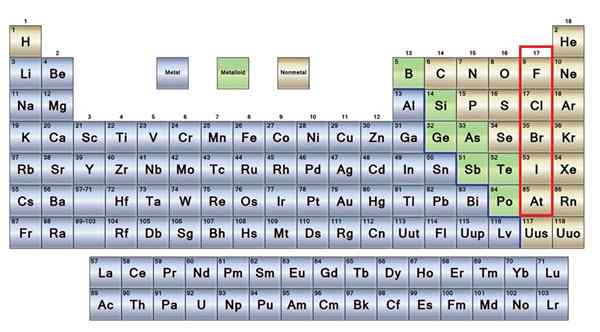 Ikke -metalliske elementer i brun
Ikke -metalliske elementer i brun En god del av ikke -metalene er til stede i alle levende vesener i form av forbindelser og makromolekyler. For eksempel: Karbon, oksygen og hydrogen er til stede i alle proteiner, lipider, karbohydrater og nukleinsyrer.
Fosfor er til stede i alle nukleinsyrer og i noen karbohydrater og lipider. Svovel finnes i mange proteiner. Nitrogen er en del av alle nukleinsyrer og proteiner.
På den annen side er underjordiske, metangasser og oljerås nesten sammensatt av ikke -metalliske elementer. Faktisk gir hydrokarboner (karbon og hydrogen) en ide om hvor rikelig de ikke -metalene er til tross for deres lavere antall elementer i det periodiske bordet.
[TOC]
Historie
Fra antikken (3750 til.C.) Egypterne brukte kull for å redusere kobber som er til stede i sineralene, for eksempel Corvelita og Malachite.
I 1669 klarte Hennin Brand å isolere samlet urinfosfor. Henry Cavendish (1776) oppnådde identifisering av hydrogen, selv om flere forskere, inkludert Robert Boyle (1670), produserte hydrogen ved å reagere en sterk syre med et metall.
Carl Scheele produserte oksygen ved oppvarming av kvikksølvoksid med nitrater (1771). Curtois klarte å isolere jod, mens han prøvde å tilberede saltterter fra tang (1811). Balard og Gmelin isolerte Bome (1825).
I 1868, Janssen og Lockger Independent. Moissan klarte å isolere fluor (1886).
I 1894 oppdaget Lord Rayleigh og Ramsey Argon ved å studere nitrogenegenskaper. Ramsay og Travers (1898) isolerte Crypton, Neon og Xenon of the Liquid Argon, ved kryogen destillasjon av luften.
Fysiske og kjemiske egenskaper
 Svovel er et av de mest representative ikke -metalliske elementene. Kilde: Ben Mills via Wikipedia.
Svovel er et av de mest representative ikke -metalliske elementene. Kilde: Ben Mills via Wikipedia. Fysisk
Noen av de fysiske egenskapene til ikke -metaller er:
-De har lav elektrisk ledningsevne, bortsett fra karbon i form av grafitt, som er en god elektrisitetsleder.
Kan tjene deg: Heptano (C7H16): Struktur, egenskaper og bruk-De kan oppstå under fysisk utseende av faste stoffer, væsker eller gasser.
-De har lav termisk konduktans, med unntak av karbon i form av diamant som ikke oppfører seg som en termisk isolator.
-De har liten glans, i motsetning til metallmetall lysstyrke.
-Ikke -metalliske faste stoffer er sprø, så de er ikke duktile eller formbare.
-De har lave smelte- og kokepunkter.
-De kan presentere forskjellige krystallinske strukturer. Dermed har fosfor, oksygen og fluor en kubikk krystallinsk struktur; Hydrogen, karbon og nitrogen, sekskantet; og svovel, klor, brom og jod, Ortorrombic.
Kjemi
Ikke metaller er preget av å ha høy ioniseringsenergi og en høy elektronegativitetsverdi. Fluor har for eksempel størst elektronegativitet (3,98), og er det mest reaktive elementet av ikke -metaller.
Men overraskende har Noble Gases Helium (5.5) og Neon (4.84) størst elektronegativitet. Imidlertid er de kjemisk inerte for å ha eksterne elektroniske lag fulle.
Ikke -metaller danner ioniske forbindelser med metaller, og kovalente med ikke -metaller.
Ikke -metalliske elementer danner diatomiske molekyler, koblet med kovalente bindinger. I mellomtiden er atomene med edle gasser i form av atomenheter.
De danner syreoksider som reagerer med vannoppstarter syrer.
Ikke -metall- og elementgrupper

Gruppe 1
Det utgjøres av hydrogen en fargeløs og toalettgass, dialotomisk. Oksidasjonstilstand +1. Den har mindre tetthet enn luft. I fast tilstand presenterer den en sekskantet krystallinsk struktur. Hydrogen er et lite reaktivt element.
Gruppe 14
Karbon er den eneste ikke -metallen som tilhører denne gruppen. Karbon i form av grafitt er et skinnende fast stoff, med en sekskantet krystallinsk struktur. Har høy elektrisk ledningsevne. Dens vanligste oksidasjonstilstander er +2 og +4.
Gruppe 15
Nitrogen
Fargeløs og toalettgass. Det er et lite reaktivt element og litt tettere enn luften. Mer vanlig oksidasjonstilstander: -3 og +5. Danner diatomiske molekyler, n2.
Kamp
Solid, fargen kan være hvit, gul eller svart. Lite reaktiv. Ortorrombisk krystallinsk struktur. Elektronegativitet 2,1. Mer vanlig oksidasjonstilstander: -3 og +5.
Gruppe 16
Oksygen
Fargeløs gass eller blekblått, toalett. Generelt ikke reaktiv. Kubikk krystallinsk struktur. Det er en isolator og et sterkt oksidasjonsmiddel. Elektronegativitet 3.5. Oksidasjonstilstand -2
Svovel
Lyse gult fast, sprøtt, moderat reaktiv. Ortorrombisk krystallinsk struktur. Danner kovalente bindinger. Elektronegativitet 2.5. Mer vanlig oksidasjonstilstander: -2, +2, +4 og +6.
Selen
Svart grå eller rødlig faststoff. Grått selen viser lysfølsom elektrisk ledningsevne. Det er et mykt og sprøtt fast stoff. Elektronegativitet 2.4. Oksidasjon sier: -2, +2, +4 og +6.
Kan tjene deg: kaliumhydroksyd: struktur, egenskaper, brukGruppe 17
Fluor
Det er en blekgul gass, veldig giftig. Det er et veldig reaktivt element. Det presenteres som diatomiske molekyler, f2. I fast tilstand krystalliserer seg i kubisk form. Elektronegativitet 3,98. Oksidasjonstilstander -1.
Klor
Det er en grønngul gass. Presenterer diatomiske molekyler, CL2. Det er veldig reaktivt. I fast tilstand er den krystallinske strukturen ortorrombisk. Elektronegativitet 3.0. Oksidasjon sier: - 1, +1, +3, +5, +7.
Brom
Det er en rød-kafévæske. Elektronegativitet 2.8. Oksidasjonstilstander -1, +1, +3, +5 og +7.
Jod
Det er et svart fast stoff som når det er sublimater avgir en fiolett damp. Ortorrombisk krystallinsk struktur. Metalljodider er ioniske. Elektronegativitet 2.5. Oksidasjon sier: -1, +1, +3, +5, y +7.
Astato
Det er et svart fast stoff. Kubikk krystallinsk struktur sentrert i ansiktet. Elektronegativitet 2,2. Det er et svakt oksidasjonsmiddel.
Gruppe 18
Helium
Har høy termisk ledningsevne. Elektronegativitet 5.5. Den er kjemisk inert og ikke brannfarlig. Lav tetthet og høy fluiditet.
Neon
Høy kjølekapasitet i flytende tilstand. Elektronegativitet 4.84. Det er det minst reaktive av edle gasser.
Argon
Det er tettere enn luften. Kjemisk inert. Elektronegativitet 3.2.
Krypton
Elektronegativitet 2.94. Kan reagere med fluor for å danne krypton -difluorid (KRF2).
Xenon
Krysser blodets hjernebarriere. Svarer på elektrisk strøm som produserer lys. Elektronegativitet 2,2. Kompleks form med fluor, gull og oksygen.
Radon
Det er et radioaktivt element. Elektronegativitet 2.06. Formforbindelser med fluor (RNF2) og med oksygen (RNO3).
applikasjoner
Hydrogen

Det brukes i rakettfremdrift og som drivstoff i bilmotorer som bruker hydrogen. Det brukes i ammoniakksyntese (NH3) og i hydrogenering av fett.
Karbon
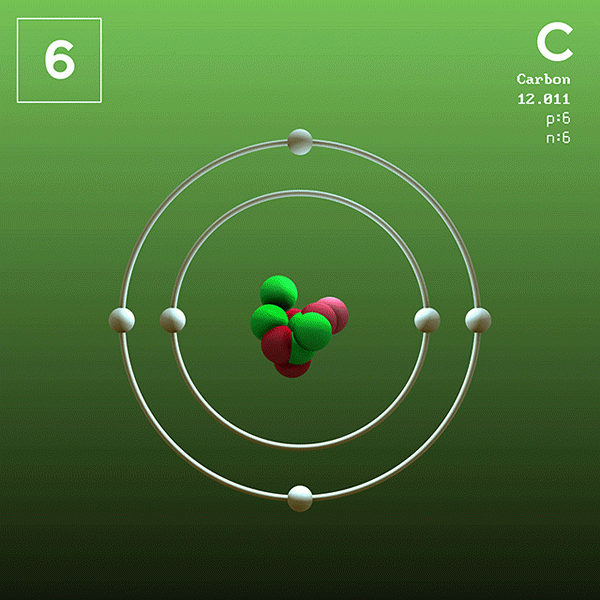
Grafitt brukes til fremstilling av blyanter og høye motstandsfibre som brukes til utdyping av sportsartikler. Diamanten brukes som en juvel av stor verdi og i boreøvelsene som slipende. Karbondioksid brukes til utdyping av brus.
Nitrogen
Det brukes i produksjonen av ammoniakk, salpetersyre og urea. Nitrogen er et essensielt element for planter og brukes i gjødselproduksjon.
Kamp
Hvitt fosfor brukes som et ratikid, insektmiddel og i pyroteknisk industri. Rød fosfor brukes i matcher produksjon. Forbindelsene brukes også i gjødselutdyping.
Oksygen
Oksygen brukes til utdyping av stål, plast og tekstiler. Det brukes også i rakett, oksygenbehandling og pustehjelp i fly, ubåter og romflyvninger.
Kan tjene deg: Erbio: struktur, egenskaper, innhenting, brukSvovel
Det brukes som råstoff for produksjon av svovelsyre, krutt og i vulkaniseringen av gummi. Sulfitter brukes til å bleke papir og soppmiddel.
Selen
Det brukes til å formidle glasset en skarlagen rød farge. Det brukes også til å nøytralisere grønnaktig nyanse produsert av glassforurensning med jernforbindelser. Det brukes i fotoelektriske celler med påføring på dører og heiser.
Fluor

Det legges til tannkremer for å forhindre karies. Hydrogenfluor brukes som råstoff for teflon. Monoatomisk fluor brukes til fremstilling av halvledere.
Klor
Det brukes i utvinningsmetallurgi og hydrokarbonklorering for fremstilling av forskjellige produkter som PVC. Klor brukes i tre- og tekstilmassebleking. Det brukes også som et vanndesinfeksjonsmiddel.
Brom
Det brukes i fremstilling av sølvbromid for lysfølsomme linser og i fotografiske filmer brukes det også i utdypingen av beroligende natriumbromid og dibrometan, en anti -domene -komponent av bensin.
Jod
Kaliumjodid (Ki) tilsettes for å forhindre struking av skjoldbruskkjertelen. Jodtinktur brukes som antiseptisk og kimmaskin. Jod er en del av skjoldbruskhormoner.
Helium
Det brukes i fylling av varmluftsballonger og blandet med oksygen for pust i dypt vann. Den brukes til sveiser i en inert atmosfære, og hjelper til med å opprettholde svært lave forskningstemperaturer.
Neon
I glassrør som lyser opp for virkning av strøm (neonrøde lys).
Argon
Det brukes til å skape en atmosfære for sveising og i fylling av glødelys.
Xenon
En blanding av xenon og krypton brukes til produksjon av blink av stor intensitet i den korte term -fotografiske utstillingen.
Radon
Det brukes i behandlingen av kreftsvulster ved strålebehandling.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Mathews, c. K., Van Holde, K. OG. Og Ahern, K. G. (2002). Biokjemi. Tredje utgave. Redigere. Pearson-Addison Wesley
- Helmestine, Anne Marie, PH.D. (6. oktober 2019). Hva er egenskapene til ikke -metaller? Gjenopprettet fra: Thoughtco.com
- Wikipedia. (2019). Ikke -metall. Hentet fra: i.Wikipedia.org
- Redaktørene av Enyclopaedia Britannica. (5. april 2016). Ikke -metall. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Jose m. Gavira Vallejo. (27. januar 2016). Hva er pnikogenene? Og icosogenos, krystallogenene, kalsogenene .. ? Hentet fra: Triplenlace.com

