Fluorhistorie, egenskaper, struktur, innhenting, risiko, bruk
- 2410
- 91
- Dr. Andreas Hopland
Han Fluor Det er et kjemisk element som er representert med F -symbolet og hodegruppen 17, som halogenene tilhører. Det kjennetegnes over de andre elementene i det periodiske tabellen, for å være det mest reaktive og elektronegative; reagerer nesten med alle atomer, så det danner utallige salter og organisasjonsforbindelser.
Under normale forhold er det en blekgul gass, som kan forveksles med gulaktig grønn. I flytende tilstand, vist i det nedre bildet, intensiveres den gule fargen litt mer, noe som forsvinner fullstendig når den stivner i frysepunktet.
 Flytende fluor i et testrør. Kilde: fulvio314 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Flytende fluor i et testrør. Kilde: fulvio314 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Det er en slik reaktivitet, til tross for den flyktige av gassen, som forblir fanget i jordskorpen; Spesielt i form av fluorittmineral, kjent for sine fiolette krystaller. På samme måte gjør reaktiviteten det til et potensielt farlig stoff; reagerer kraftig med alt som berører og brenner i flammer.
Imidlertid kan mange av de avledede produktene være ufarlige og til og med gunstige, avhengig av applikasjoner. For eksempel består den mest populære bruken av fluor, tilsatt i sin ioniske eller mineralform (som fluorsalter), av fremstilling av tannpastaer med fluor, som hjelper til med å beskytte tannemaljen.
Fluor presenterer særegenheten som høye antall eller oksidasjonstilstander kan stabilisere seg for mange andre elementer. Jo større antall fluoratomer, jo mer reaktiv vil forbindelsen være (med mindre det er en polymer). På samme måte vil virkningene med molekylære matriser øke; på godt og vondt.
[TOC]
Historie
Bruk av fluoritt
I 1530 oppdaget den tyske mineralogen Georgius Agricola at fluorspar mineral kunne brukes i metallrensing. Fluorspar er et annet navn for fluor, et fluormineral som besto av kalsiumfluorid (CAF2).
Fluorelementet hadde ikke blitt oppdaget da, og "fluoir" i fluoritten kom fra det latinske ordet "fluere" som betyr "flyt"; Siden dette var hva fluorspar eller fluoritt gjorde med metaller: det hjalp dem til å forlate prøven.
Forberedelse av fluorhorinsyre
I 1764 klarte Andreas Sigismud Margraff. Glassreturer smeltet av virkningen av syre, så glasset ble erstattet av metaller.
Det tilskrives også Carl Scheele i 1771, fremstilling av syre ved samme metode etterfulgt av Margraff. I 1809 foreslo den franske forskeren Andre-Marie Ampere at fluorisk eller fluorhorinsyre var en forbindelse dannet av hydrogen og et nytt element som ligner på klor.
Forskere prøvde å isolere fluor gjennom bruk av fluorhorisk syre i lang tid; Men faren gjorde fremgang i denne forbindelse.
Humphry Davy, Joseph Louis Gay-Lussac og Jacques Thénard hadde sterke smerter når de inhalerte hydrogenfluoridet (fluoridsyre uten vann og i en gassform))). Under lignende omstendigheter døde forskere Paulin Louyet og Jerome Nickles ved forgiftning.
Edmond Fréme, fransk forsker, prøvde å lage tørr fluorhoridsyre for å unngå toksisiteten til hydrogenfluorid ved forsuring av kaliumbifluorid (KHF2), Men under elektrolyse var det ingen ledning av elektrisk strøm.
Isolering
I 1860 prøvde den engelske kjemikeren George Gore. Imidlertid var det en eksplosjon ved voldsomt rekombrende hydrogen med fluor. Gore tilskrev eksplosjonen til en oksygenlekkasje.
I 1886 klarte den franske kjemikeren Henri Moisson å isolere fluor for første gang. Tidligere ble Moissons arbeid avbrutt fire ganger på grunn av alvorlig forgiftning med hydrogenfluorid, mens han prøvde å isolere elementet.
Moisson var en frony student og var basert på eksperimentene sine for å isolere fluor. Moisson brukt i elektrolyse En blanding av kaliumfluor og fluorhorsyre. Den resulterende løsningen ledet elektrisitet og fluorass akkumulert i anoden; det vil si i den positive lastede elektroden.
Moisson brukte et korrosjonsresistent utstyr, der elektrodene var laget av en platina- og iridiumlegering. I elektrolyse brukte den en platinabeholder og avkjølte den elektrolytiske oppløsningen ved en temperatur på -23 ºF (-31 ºC).
Til slutt, 26. juni 1886, klarte Henri Moisson å isolere fluor, et verk som tillot ham å vinne Nobelprisen i 1906.
Interesse for fluor
For en stund gikk interessen for etterforskning med fluor tapt. Imidlertid utviklingen av Manhattan -prosjektet for produksjon av atombomben.
Det amerikanske selskapet DuPont utviklet, mellom 1930 og 1940, fluorerte produkter som klorofluorokarbonater (Freon-12), brukt som kjølemedier; og polyetrafluoretylenplast, kjent med navnet teflon. Dette ga en økning i fluorproduksjon og forbruk.
I 1986, på en konferanse for et århundre med fluorisolasjon, den amerikanske kjemikeren Karl eller. Christe presenterte en kjemisk metode for fremstilling av fluor ved reaksjon mellom K2MNF6 og SBF5.
Kan tjene deg: polyvinylalkoholFysiske og kjemiske egenskaper
Utseende
Fluor er en blekgul gass. I flytende tilstand er det knallgult. I mellomtiden kan det faste stoffet være ugjennomsiktig (alfa) eller gjennomsiktig (beta).
Atomnummer (z)
9.
Atomvekt
18.998 u.
Smeltepunkt
-219,67 ºC.
Kokepunkt
-188.11 ºC.
Tetthet
Ved romtemperatur: 1.696 g/l.
Ved smeltepunktet (væske): 1 505 g/ml.
Fordampningsvarme
6.51 kJ/mol.
Molar kalorikapasitet
31 J/(mol · k).
Damptrykk
Ved en temperatur på 58 K har et 986,92 atm damptrykk.
Termisk ledningsevne
0,0277 w/(m · k)
Magnetisk ordre
Diamagnetisk
Lukt
Krydret og gjennomtrengende karakteristisk lukt, påvisbar selv ved 20 ppb.
Oksidasjonstall
-1, som tilsvarer fluoranion, f-.
Ioniseringsenergi
-Først: 1.681 kJ/mol
-For det andre: 3.374 kJ/mol
-Tredje: 6.147 kJ/mol
Elektronegativitet
3.98 på Pauling -skalaen.
Det er det kjemiske elementet med det største av elektronegativiteter; det vil si at den har en høy affinitet for elektronene til atomene den er koblet. På grunn av dette genererer fluoratomer store dipolmomenter i spesifikke regioner av et molekyl.
Hans elektronegativitet har også en annen effekt: atomer knyttet til ham mister så mye elektronisk tetthet at de begynner å skaffe seg en positiv belastning; Dette er et positivt oksidasjonsnummer. Jo mer fluoratomer i en forbindelse, det sentrale atomet vil ha et mer positivt oksidasjonsnummer.
For eksempel i av2 Oksygen har et oksidasjonsnummer på +2 (eller2+F2-); I UF6, Uran har et oksidasjonsnummer på +6 (u6+F6-); Det samme gjelder svovel i SF6 (S6+F6-); Og endelig er AGF2, der sølv til og med har et oksidasjonsnummer på +2, uvanlig i det.
Derfor klarer elementene å delta med sine mest positive oksidasjonstall når de danner forbindelser med fluor.
Oksidasjonsmiddel
Fluor er det kraftigste oksidasjonselementet, så ingen stoffer er i stand til å oksidere det; Og av denne grunn er han ikke fri.
Reaktivitet
Fluor er i stand til å kombinere med alle andre elementer, bortsett fra med helium, neon og argon. Det angriper heller ikke søtt stål eller kobber ved normale temperaturer. Reagerer voldsomt med organiske materialer, for eksempel gummi, tre og stoff.
Fluor kan reagere med den edle gassen Xenon for å danne den sterke difluoruro -oksidanten av Xenon, xef2. Den reagerer også med hydrogen for å danne et halogenid, hydrogenfluorid, HF. På sin side blir hydrogenfluorid oppløst i vann for å produsere den berømte fluorhorsyre (spis glass).
Surheten i hydrasesyrer, klassifisert i økende rekkefølge er:
Hf < HCl < HBr < HI
Salpetersyre reagerer med fluor for å danne fluornitrat, FNO3. I mellomtiden reagerer saltsyre kraftig med fluor for å danne HF, av2 og CLF3.
Elektronisk struktur og konfigurasjon

Diatomisk molekyl
 Fluormolekyl representert med romfyllingsmodell. Kilde: Gabriel Bolívar.
Fluormolekyl representert med romfyllingsmodell. Kilde: Gabriel Bolívar. Fluoratomet i sin basaltilstand har syv elektroner i Valencia, som er i orbitalene 2s og 2p i henhold til den elektroniske konfigurasjonen:
[Han] 2s2 2 s5
Valencia Link Theory (TEV) slår fast at to fluoratomer, F, er kovalent koblet for å kunne fullføre oktetten sin i Valencia hver.
Dette skjer raskt fordi det knapt mangler et elektron for å bli isolektronisk for edel neongass; Og atomene er veldig små, med en veldig sterk effektiv kjernefysisk belastning som lett krever miljø i miljøet.
Molekylet f2 (Overlegen bilde), har en enkel kovalent lenke, f-f. Til tross for sin stabilitet sammenlignet med frie F -atomer, er det et ekstremt reaktivt molekyl; Homonukleær, apolar og ivrig etter elektroner. Det er grunnen til at fluor, som f2, Det er en veldig giftig og farlig art.
Fordi f2 Det er apolar, interaksjonene avhenger av dens molekylmasse og spredningskreftene i London. På et tidspunkt må den elektroniske skyen rundt begge F -atomer deformere og stamme en øyeblikkelig dipol som induserer en annen i et nærliggende molekyl; slik at de er sakte og svake.
Væske og fast
Molekylet f2 Den er veldig liten og sprer seg i verdensrommet med relativ hastighet. I sin gassfase viser den en blek gul farge (som kan forveksles med en kalkgrønn). Når temperaturen synker til -188 ºC, blir spredningskreftene mer effektive og gjør molekylene f2 samhold nok til å definere en væske.
Flytende fluor (første bilde), ser enda mer gul ut enn dens respektive gass. I den molekylene f2 De er nærmere og samhandler med lyset i større grad. Interessant nok, når det forvrengte kubikkglasset er dannet fra fluor til -220 ºC, blekner fargen og forblir et gjennomsiktig faststoff.
Kan tjene deg: forgrenede alkanerNå som m -molekylene2 De er så nære (men uten at molekylære rotasjoner stopper) ser det ut til at elektronene deres tjener litt stabilitet, og derfor er deres elektroniske hopp for stort til at lyset til og med samhandler med glasset.
Krystallinske faser
Denne kubikkkrystallen tilsvarer β -fasen (den er ikke en alotropisk fordi den forblir den samme f2). Når temperaturen synker enda mer, opp til -228 ºC, lider den faste fluoren en faseovergang; Kubikkglasset blir transformert til en monoklinisk, α -fasen:
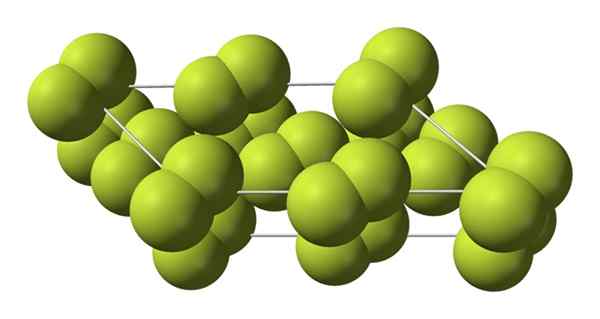
 Krystallinsk struktur av alfafasen av fluor. Kilde: Benjah-BMM27 [Public Domain].
Krystallinsk struktur av alfafasen av fluor. Kilde: Benjah-BMM27 [Public Domain]. I motsetning til β-F2, Α-f2 er ugjennomsiktig og hard. Kanskje er det fordi M -molekylene2 De har ikke lenger slik frihet til å rotere i sine faste posisjoner i monokliniske krystaller; der de i større grad samhandler med lyset, men uten å begeistre elektronene sine (noe som overfladisk vil forklare deres opacitet).
Den krystallinske strukturen til α-f2 Det var vanskelig å studere gjennom konvensjonelle røntgendiffraksjonsmetoder. Dette er fordi overgangen fra fase β til α er veldig eksoterm; Så krystallen utnyttet praktisk talt, mens han samhandlet lite med stråling.
De tilbrakte omtrent femti år før tyske forskere (Florian Kraus og samarbeidspartnere), de tyderier α-F-strukturen fullstendig2 med større presisjon takket være nøytrondiffraksjonsteknikker.
Hvor er det og skaffer seg
Fluor okkuperer den 24. av de vanligste elementene i universet. Imidlertid er på jorden i messe 13vo element, med en konsentrasjon på 950 ppm i jordskorpen, og en konsentrasjon på 1,3 ppm i sjøvann.
Jordsmonnene har en fluorkonsentrasjon mellom 150 og 400 ppm, og på noe jord kan konsentrasjonen nå 1.000 ppm. I den atmosfæriske luften er den til stede i en konsentrasjon på 0,6 ppb; Men det har registrert seg i noen byer opp til 50 ppb.
Fluor oppnås hovedsakelig fra tre mineraler: fluoritt eller fluorospar (kaffe2), Fluoroapatita [CA5(Po4)3F] og kreolsk (na3Alf6).
Fluorprosessering
Etter å ha samlet steinene med fluor mineral, er disse underlagt primær og sekundær knusing. Med sekundær knusing av å oppnå veldig små bergfragmenter.
Deretter blir bergfragmenter ført til en kulefabrikk for støvreduksjon. Vann og reagenser tilsettes for å danne en pasta, som er plassert i en flotasjonstank. Det injiseres med trykk for å danne bobler, og dermed havner fluoritten på den vandige overflaten.
Silikater og karbonater er sediment mens fluoritt blir samlet og fører til tørkeovner.
Når fluoritt er oppnådd, reagerte den med svovelsyre for å produsere hydrogenfluorid:
Caf2 + H2SW4 => 2 HF +sak4
Hydrogenfluoridelektrolyse
I fluorproduksjon følges noen modifikasjoner, med metoden som ble brukt av Moisson i 1886.
En elektrolyse av en blanding av smeltet kaliumfluorid og fluhydrric acid lages, med en molar radius på 1: 2,0 til 1: 2.2. Den smeltede salttemperaturen er 70 - 130 ºC.
Katoden består av en monet eller stållegering, og anoden er av reografisk kull. Fluorproduksjonsprosessen under elektrolyse kan skjematiseres som følger:
2HF => H2 + F2
Vann brukes til å avkjøle elektrolysekammeret, men temperaturen må være over smeltepunktet til elektrolytten for å unngå størkning. Hydrogen produsert i elektrolyse samles i katoden, mens fluor i anoden.
Isotoper
Fluoren har 18 isotoper, og er 19F den eneste stabile isotopen med 100% overflod. Han 18F har en halvliv på 109,77 minutter og er den radioaktive isotopen av fluor med størst halvliv. Han 18F den brukes som en positronkilde.
Biologisk papir
Ingen metabolsk aktivitet av fluor hos pattedyr eller øvre planter er kjent. Noen sjøplanter og svamper syntetiserer imidlertid monofluroacetat, en giftig forbindelse, som bruker som beskyttelse for å unngå ødeleggelse.
Risiko
Overdreven fluorforbruk har vært assosiert med beinfluorose hos voksne og tannfluorose hos barn, samt med endringer i nyrefunksjon. Av denne grunn antydet USA.
I mellomtiden konstaterte det amerikanske Enviromental Protection Agency (EPA) at konsentrasjonen av fluor i drikkevann ikke skulle være større enn 4 mg/l, for å unngå skjelettfluorose, der fluor akkumuleres i beinene. Dette kan forårsake svekkelse av bein og brudd.
Fluor har vært relatert til skade på parathyreoidekjertelen, med en reduksjon i kalsium i beinstrukturer og høye kalsiumkonsentrasjoner i plasma.
Det kan tjene deg: levende materie: konsept, egenskaper og eksemplerBlant endringene som tilskrives overflødig fluor er følgende: tannfluorose, skjelettfluorose og skade på paratyroidkjertelen.
Tannfluorose
Tannfluorose blir presentert med små striper eller motorsykler i tannemaljen. Barn under 6 år skal ikke bruke munnvann som inneholder fluor.
Skjelettfluorose
I skjelettfluorose kan smerter og skade skader diagnostiseres, så vel som i leddene. Benet kan herde og miste elastisiteten, noe som øker risikoen for brudd.
applikasjoner
Tannkrem
 Noen uorganiske salter av fluor brukes som tilsetningsstoff i formuleringen av tannpastaer, som har vist at de hjelper til med å beskytte tannemaljen. Kilde: Pxhere.
Noen uorganiske salter av fluor brukes som tilsetningsstoff i formuleringen av tannpastaer, som har vist at de hjelper til med å beskytte tannemaljen. Kilde: Pxhere. Vi starter med delen av bruksområdene for fluor med det mest kjente: å tjene som en komponent i mange tannpastaer. Dette er ikke den eneste bruken der kontrasten mellom molekylet F kan sees2, ekstremt giftig og farlig, og anion f-, som avhengig av omgivelsene kan være gunstig (selv om noen ganger ikke).
Når vi spiser mat, spesielt søtsaker, ødelegger bakterier dem ved å øke surheten i spytt. Deretter er det et punkt hvor pH er nok til å fornedre og demineralisere tannemaljen; Hydroxiapatitt kommer "ned".
Imidlertid, i denne prosessen- samhandle med Ca2+ å danne en fluorapatittmatrise; mer stabil og varig enn hydroksyapatitt. Eller i det minste er dette den foreslåtte mekanismen for å forklare virkningen av fluoranionen på tennene. Det er sannsynlig at det er mer sammensatt og at det er en hydroksyapatitt-fluorapatitt avhengig av pH.
Disse anionene f- De er tilgjengelige i tannpapas i salter; slik som: NAF, SNF2 (Den berømte stine fluor) og napof. Imidlertid konsentrasjonen av f- Det må være lavt (mindre enn 0,2%), siden det ellers forårsaker negative effekter på kroppen.
Vannfluorisering
Svært lik hvordan med tannpastaer har fluorsalter blitt lagt til drikkevannskilder for å bekjempe utseendet til karies hos de som drikker det. Konsentrasjonen må fortsatt være mye lavere (0,7 ppm). Imidlertid er denne praksisen vanligvis mistillit og kontrovers, ettersom mulige kreftfremkallende effekter er blitt tilskrevet.
Oksidasjonsmiddel
Gassen f2 Det oppfører seg som et veldig sterkt oksidasjonsmiddel. Dette får mange forbindelser til å ordne mer enn når de blir utsatt for oksygen og en varmekilde. Derfor har det blitt brukt i rakettdrivstoffblandinger, der de til og med kan erstatte ozon.
Polymerer
I mange bruksområder skyldes ikke fluorbidrag2 eller f-, men direkte til elektronegative atomer som utgjør en del av en organisk forbindelse. Derfor, i essensen av en C-F-kobling.
Avhengig av strukturen er polymerer eller fibre med C-F-bindinger vanligvis hydrofobe, slik at de ikke blir våte eller motstår angrepet av fluorhorsyre; Eller enda bedre, de kan være utmerkede elektriske isolatorer, og nyttige materialer som gjenstander som rør og skjøter produseres. Teflon og Navion er eksempler på disse fluorerte polymerene.
Farmasøyter
Reaktiviteten til fluor kalles bruken av den for syntese av multippel fluor, organiske eller uorganiske forbindelser. Hos organiske, spesifikt de med farmakologiske effekter, erstatter en av deres heteroátomos med atomer f øker (positivt eller negativt) dens handling på deres biologiske mål.
Det er grunnen til at i legemiddelindustrien er modifiseringen av noen medisiner alltid på bordet ved å tilsette fluoratomer.
Veldig likt forekommer med ugressmidler og soppdrepende midler. Fluoren i dem kan øke sin virkning og effektivitet på insekter og soppskadegår.
Glassgravering
Fluorhorinsyre, på grunn av dens aggressivitet med glass og keramikk, har blitt brukt til å registrere tynne og delikate biter av disse materialene; Vanligvis beregnet på fremstilling av datamaskiner mikrokomponenter, eller for elektriske pærer.
Uranberikelse
En av de mest relevante bruken av elementært fluor er å hjelpe til med å berike uran som 235ELLER. For å gjøre dette, oppløses uranmineraler i fluorhorinsyre, og produserer UF4. Dette uorganiske fluoridet reagerer deretter med f2, Å transformere til UF6 (235PUH6 og 238PUH6).
Deretter, og gjennom en gasssentrifugering, 235PUH6 Det skiller seg fra 238PUH6 og deretter oksidert og lagret som kjernebrensel.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Krämer Katrina. (2019). Frossen fluors struktur ble revet etter 50 år. Royal Society of Chemistry. Gjenopprettet fra: Chemistryworld.com
- Wikipedia. (2019). Fluor. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). Fluor. PubChem -database. CID = 24524. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2019). Fakta fra fluorelement. Chemicool. Gjenopprettet fra: Chemicool.com
- Batul Nafisa Baxamusa. (21. februar 2018). Den overraskende vanlige bruken av den svært reaktive fluoren. Gjenopprettet fra: Sciencestruck.com
- Paola Opazo Sáez. (4. februar 2019). Fluor i tannkrem: er det bra eller dårlig for helse? Gjenopprettet fra: NacionFarma.com
- Karl Christe & Stefan Schneider. (8. mai 2019). Fluor: kjemisk element. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Lentech b.V. (2019). Periodebord: oksygen. Gjenopprettet fra: Lentech.com
- Gagnon Steve. (s.F.). Elementet fluor. Jefferson Lab. Gjenopprettet fra: Utdanning.Jlab.org
- American Cancer Society Medical and Editorial Content Team. (28. juli 2015). Vannfluorering og kreftrisiko. Gjenopprettet fra: Kreft.org
- « Eksakte vitenskapskarakteristikker, hva studerer du, eksempler
- Ingen metaller historie, egenskaper, grupper, bruker »

