Spektral notasjon

- 2348
- 414
- Daniel Skuterud
 Tabell som indikerer nivåene og orbitaler
Tabell som indikerer nivåene og orbitaler Hva er spektral notasjon?
De Spektral notasjon Det er arrangementet av elektroner ved energinivå rundt kjernen til et atom. I følge Bohrs gamle atommodell okkuperer elektroner flere nivåer i baner rundt kjernen, av det første laget nærmest kjernen, k, til det syvende laget, Q, som er den fjerneste fra kjernen.
Når det.
Vanligvis brukes elektronisk konfigurasjon for å beskrive orbitalene til et atom i dets grunnleggende tilstand, men det kan også brukes til å representere et atom som har blitt ionisert i en kation eller anion, og kompenserer med tap eller gevinst av elektroner i sine respektive orbitaler.
Mange av de fysiske og kjemiske egenskapene til elementene kan korreleres med deres unike elektroniske konfigurasjoner. Valencia -elektroner, elektroner i det ytterste laget, er den avgjørende faktoren for elementets unike kjemi.
Når elektroner i det ytterste laget av et atom får energi fra noe slag, beveger de seg til større energisjikt. Dermed vil et elektron i K -laget bli overført til laget L som er i en tilstand av største energi.
Når elektronet går tilbake til sin grunnleggende tilstand, frigjør den energien den absorberes ved å avgi et elektromagnetisk spekter (lys). Siden hvert atom har en spesifikk elektronisk konfigurasjon, vil det også ha et spesifikt spekter som vil bli kalt absorpsjon (eller utslipp) spektrum.
Av denne grunn brukes begrepet spektral notasjon for å referere til elektronisk konfigurasjon.
Hvordan bestemme spektralnotasjonen: kvantetall
Totalt fire kvantetall brukes til å beskrive bevegelsen og banene til hvert elektron inne i et atom fullstendig.
Kombinasjonen av alle kvantetall av alle elektroner i et atom er beskrevet av en bølgefunksjon som oppfyller Schrödinger -ligningen. Hvert elektron i et atom har et unikt sett med kvantetall.
Det kan tjene deg: molar fraksjon: hvordan det beregnes, eksempler, øvelserI følge Paulis eksklusjonsprinsipp kan ikke to elektroner dele den samme kombinasjonen av fire kvantetall.
Kvantetall er viktige fordi de kan brukes til å bestemme den elektroniske konfigurasjonen av et atom og den sannsynlige plasseringen av atomelektroner.
Kvantetall brukes også for å bestemme andre egenskaper ved atomer, for eksempel ioniseringsenergi og atomradius.
Kvantetall betegner spesifikke skjell, underkapsler, orbitaler og elektroner svinger.
Dette betyr at de fullstendig beskriver egenskapene til et elektron i et atom, det vil si at de beskriver hver enkelt løsning til Schrödinger -ligningen, eller bølgefunksjonen, elektroner i et atom.
Det er totalt fire kvantetall: det viktigste kvantetallet (n), kvantetallet til orbital kantete (l), det magnetiske kvantetallet (ml) og kvantetallet til elektronspinnet (MS).
Det viktigste kvantetallet, nn, beskriver energien til et elektron og den mest sannsynlige avstanden til kjerneelektronet. Med andre ord, det refererer til størrelsen på orbitalen og energinivået som et elektron er plassert.
Antall underkapsler, eller LL, beskriver formen til orbital. Det kan også brukes til å bestemme antall vinkelnoder.
Det magnetiske kvantetallet, ML, beskriver energinivåer i et undercap, og refererer mer til spinnet på elektronet, som kan være opp eller ned.
Aufbau -prinsippet
Aufbau kommer fra det tyske ordet Aufbauen, Hva betyr "build". I hovedsak, når vi skriver elektronkonfigurasjoner, bygger vi elektronbaner når vi går fra et atom til et annet.
Når vi skriver den elektroniske konfigurasjonen av et atom, vil vi fylle orbitalene i økende rekkefølge av atomnummer.
Aufbau -prinsippet stammer fra Paulis eksklusjonsprinsipp, som sier at det ikke er to fermioner (for eksempel elektroner) i et atom.
Det kan tjene deg: smørsyre: formel, egenskaper, risikoer og brukDe kan ha samme sett med kvantetall, så de må "samle seg" på høyere energinivå. Hvordan elektroner akkumuleres er et tema for elektroninnstillinger.
De stabile atomene har like mange elektroner som protonene gjør i kjernen. Elektronene samles rundt kjernen i kvantebaner etter fire grunnleggende regler kalt Aufbau -prinsippet.
1. Det er ingen to elektroner i atomet som delte de samme fire kvantetallene N, L, M og S.
2. Elektroner vil først okkupere orbitalene på det laveste energinivået.
3. Elektronene vil alltid fylle orbitalene med samme spinnnummer. Når orbitalene er fulle, begynner den.
4. Elektroner vil fylle orbitaler for summen av kvantetall n og l. Orbitaler med likeverdige verdier (n + l) vil bli fylt først med lavere N -verdier.
Andre og fjerde regler er i utgangspunktet de samme. Et eksempel på regel fire ville være orbitaler 2p og 3s.
En orbital 2p er n = 2 og l = 2 og en 3s orbital er n = 3 og l = 1. (N + l) = 4 i begge tilfeller, men 2p -orbitalen har den laveste energien eller lavere verdien og vil bli fylt før lag 3s.
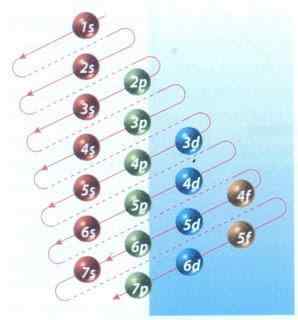 Figur 2: Moeller Diagram of Electronic Configuration Filling
Figur 2: Moeller Diagram of Electronic Configuration Filling Heldigvis kan du bruke Moeller -diagrammet vist i figur 2 for å fylle elektronene. Grafen leses ved å utføre diagonalene fra 1s.
Figur 2 viser atombaner og piler indikerer hvordan du skal følge.
Nå som det er kjent at ordens rekkefølge er fylt, er det eneste som gjenstår å huske størrelsen på hver orbital.
Orbitaler har en mulig verdi av ml Å inneholde 2 elektroner
P orbitals har 3 mulige verdier av ml Å inneholde 6 elektroner
Orbitaler har 5 mulige verdier av ml Å inneholde 10 elektroner
F orbitals har 7 mulige verdierl Å inneholde 14 elektroner
Dette er alt som trengs for å bestemme den elektroniske konfigurasjonen av et stabilt atom av et element.
Kan tjene deg: Dodecil natriumsulfat (SDS): struktur, egenskaper, brukTa for eksempel nitrogenelementet. Nitrogen har syv protoner og derfor syv elektroner. Den første orbitalen å fylle er orbital 1 -ene. En orbital S har to elektroner, så det er fem elektroner igjen.
Den neste orbitalen er 2s orbital og inneholder de to neste. De tre endelige elektronene vil gå til 2p -orbitalen som kan inneholde opptil seks elektroner.
Sinkregler
Aufbau -seksjonen diskuterte hvordan elektroner fyller de laveste energitropporene først og deretter flytter til de høyeste energitroppene bare etter at de nedre energitortene er fulle.
Imidlertid er det et problem med denne regelen. Visst.
Og de tre forskjellige orbitalene? I hvilken rekkefølge skal de fylles? Svaret på dette spørsmålet innebærer synkregel.
Vaskregelen slår fast at:
- Hver bane i et undernivå er okkupert individuelt før noen bane er dobbelt okkupert.
- Alle elektroner i individuelt okkuperte orbitaler har samme sving (for å maksimere den totale svingen).
Når elektroner blir tildelt orbitaler, søker et elektron først å fylle alle orbitaler med lignende energi (også kalt degenererte orbitaler) før de matches med et annet elektron i et halvt fulle orbital.
Atomer i jordtilstander har en tendens til å ha så mange elektroner som ikke har blitt utført som mulig. Når du visualiserer denne prosessen, bør du vurdere hvordan elektroner viser samme oppførsel som de samme stolpene i en magnet hvis de vil kontakte.
Når negativt ladede elektroner fyller orbitalene, prøver de først å komme seg så mye som mulig før de må matche.
Referanser
- Kvantetall. Chem kom seg.Librettexts.org.
- Elektronkonfigurasjoner og atomers egenskaper (S.F.). Gjenopprettet fra Oneonta.Edu.
- Elektronisk konfigurasjon. Gjenopprettet fra Britannica.com.

