Degenererte orbitaler

- 3301
- 384
- Thomas Karlsen
 Energiordning med orbitaler okkupert av manglende elektroner. Kilde: Gabriel Bolívar
Energiordning med orbitaler okkupert av manglende elektroner. Kilde: Gabriel Bolívar De Degenererte orbitaler De er de som er funnet på samme nivå av energi. I henhold til denne definisjonen må de ha samme viktigste kvantetall n. Dermed er 2s og 2p orbitaler degenerert, siden de tilhører energinivå 2, selv om det er kjent at deres funksjoner av kantete og radiale bølger er forskjellige.
Som verdiene til n, Elektroner begynner å okkupere andre energi -underutstyr, for eksempel D og F -orbitaler.
Hver av disse orbitalene har sine egne egenskaper, som ved første øyekast observeres i deres vinkelform; Dette er de sfæriske figurene (e), av hantler (p), av kløverblader (d) og kuleformet (f).
Blant dem er det en energiforskjell, til og med tilhørende samme nivå n.
For eksempel vises et energisordning med orbitaler okkupert av manglende elektroner (en unormal sak) i det øvre bildet (en unormal sak).
Det kan sees at av alt er den mest stabile (minst energien) NS -orbitalen (1s, 2s, ...), mens NF er den mest ustabile (den med den største energien).
Degenererte orbitaler av et isolert atom
Degenererte orbitaler, med samme verdi som n, De er i samme linje i et energisordning.
Av denne grunn er de tre røde stripene som symboliserer orbitalene P, plassert i samme linje; Som på samme måte gjør de lilla og gule stripene.
Bildeskjemaet bryter med vaskeegelen: orbitaler med større energi er fylt med elektroner.
Kan tjene deg: syrer og baser: forskjeller, egenskaper, eksemplerNår elektronene parer seg, mister orbitalen energi, og utøver en større elektrostatisk frastøtning på de manglende elektronene til de andre orbitalene.
Slike effekter blir imidlertid ikke vurdert i mange energidiagrammer. I så fall, og adlyde vaskeregelen uten å fylle orbitalene d, vil det sees at de slutter å være degenererte.
Som nevnt ovenfor har hver bane sine egne egenskaper. Et isolert atom, med sin elektroniske konfigurasjon, er villig til elektronene i det nøyaktige antallet orbitaler som lar dem være vertskap for dem.
Bare de i energi kan betraktes som degenerert.
Orbitals p
De tre røde stripene for orbitalene i bildet av bildet indikerer at begge Px, pog Og sz De har samme energi.
Det er et elektron som forsvinner i hver enkelt, beskrevet av fire kvantetall (n, l, ml og MS), mens de tre første beskriver orbitalene.
Den eneste forskjellen mellom dem er betegnet med det magnetiske øyeblikket ml, som trekker banen til Px På en x -akse, Pog på y -aksen, og Pz På Z -aksen.
De tre er de samme, men de er bare forskjellige i sine romlige orienteringer. Av denne grunn er de alltid trukket av energi, det vil si degenerere.
Som det samme, et inomotiv nitrogenatom (med 1S -konfigurasjon22s22 s3) Du må holde dine tre orbitaler degenerert. Imidlertid endres energiscenariet brått hvis det regnes som et atom av N i et kjemisk molekyl eller forbindelse.
Det er slik fordi selv om Px, pog Og sz De er de samme i energi, dette kan variere i hver av dem hvis de har forskjellige kjemiske miljøer; det vil si hvis de er knyttet til forskjellige atomer.
Kan tjene deg: Isopreno: Struktur, egenskaper, applikasjonerOrbitals d
De fem lilla stripene betegner orbitaler d. I et isolert atom, selv om de har sammenkoblede elektroner, anses de at disse fem orbitalene er degenererte. I motsetning til p -orbitalene, er det imidlertid en markant forskjell i deres vinkelform.
Derfor reiser elektronene deres veibeskrivelse i verdensrommet som varierer fra en orbital d til en annen.
Dette forårsaker, i henhold til Krystallinsk feltteori, at en minimal forstyrrelse forårsaker a energi som utspiller seg av orbitalene; Det vil si at de fem lilla stripene skiller seg og etterlater et energigap mellom dem:
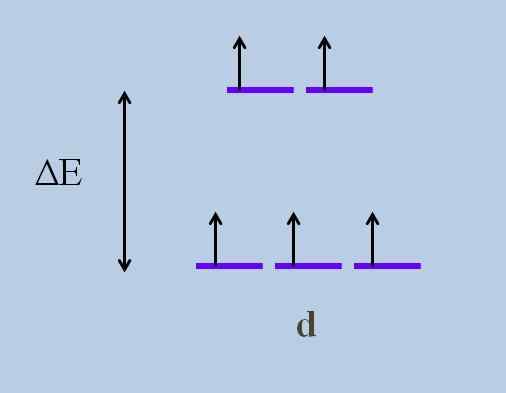 Energi utfoldet ordning av orbitaler. Kilde: Gabriel Bolívar
Energi utfoldet ordning av orbitaler. Kilde: Gabriel Bolívar Hva er orbitalene ovenfor og som er de nedenfor? De ovenfor er symbolisert som ogg, og de nedenfor t2 g.
Legg merke til hvordan innledningsvis alle lilla striper ble justert, og nå ble et sett med to orbitaler dannet ogg mer energi enn det andre settet med tre orbitaler t2 g.
Denne teorien gjør det mulig å forklare D-D-overgangene, som mange av fargene som er observert i forbindelsene til overgangsmetallene (CR, MN, Faith, etc. tildeles.).
Denne elektroniske forstyrrelsen skyldes koordineringsinteraksjonene i metallsenteret med andre molekyler som kalles Ligander.
Orbitaler f
Og med orbitalene F, de syv gule stripene, er situasjonen ytterligere komplisert. Dens romlige adresser varierer veldig mellom dem, og visualiseringen av koblingene deres blir for komplisert.
Faktisk anses det at orbitaler f er av et så indre lag at de ikke "deltar nevneverdig" i dannelsen av lenker.
Det kan tjene deg: perklorisk oksid (CL2O7)Når atomet isolert med orbitaler f er omgitt av andre atomer, begynner interaksjoner og utfoldelse oppstår (tap av degenerasjon):
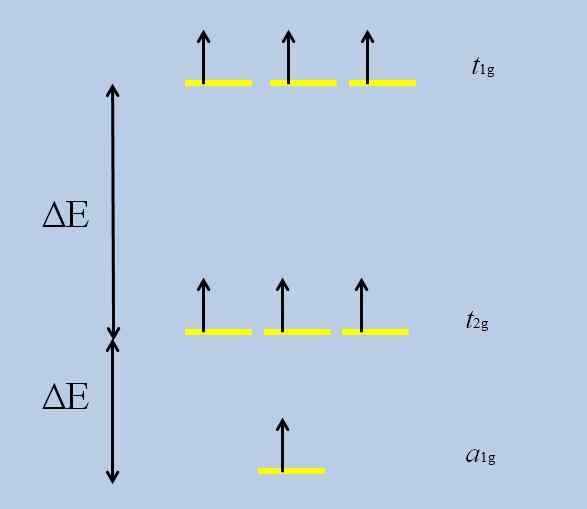 Ordningen med degenerasjonstap. Kilde: Gabriel Bolívar
Ordningen med degenerasjonstap. Kilde: Gabriel Bolívar Merk at nå danner de gule stripene tre sett: t1g, t2 g og til1g, Og de er ikke lenger degenerert.
Degenererte hybrid orbitaler
Det har blitt sett at orbitaler kan utfolde seg og miste degenerasjon. Selv om dette forklarer elektroniske overganger, avklarer det imidlertid ikke hvordan og hvorfor det er forskjellige molekylære geometrier. Her kommer hybridbanene inn.
Dets viktigste karakteristikk er at de er degenerert. Dermed oppstår de fra blandingen av orbitale tegn S, P, D og F, for å forårsake degenererte hybrider.
For eksempel er tre p -orbitaler blandet med en S for å gi fire SP -orbitaler3. Alle SP -orbitaler3 De er degenerert, og har derfor samme energi.
Hvis i tillegg er to orbitaler blandet med de fire SP3, Seks orbitaler vil bli oppnådd3d2.
Og hvordan forklarer molekylære geometrier? Ettersom det er seks, med like energier, må de følgelig ledes symmetrisk i rommet for å generere like kjemiske miljøer (for eksempel i en MF -forbindelse6).
Når de gjør det, dannes en oktaedron av koordinering, som er lik en oktaedrisk geometri rundt et senter (m).
Imidlertid presenterer geometrier vanligvis forvrengninger, noe som betyr at selv hybridbaner ikke er helt degenererte.
Derfor, som en konklusjon, eksisterer degenererte orbitaler bare i isolerte atomer eller svært symmetriske miljøer.
Referanser
- Definisjon av Degerate. Gjenopprettet fra: Chemicool.com
- Atomer og atomiske orbitaler. Gjenopprettet fra Sparknotes.com
- Whitten, Davis, Peck & Stanley. Kjemi. (8.ª Ed.). Cengage Learning.

