Oxihemoglobin -egenskaper, struktur og krysskurve
- 1228
- 65
- Prof. Oskar Aas
ENTENXihemoglobin Det er navnet som hemoglobin mottar når den blir med oksygen. Hemoglobin er et protein som er innenfor de røde blodlegemene og hvis hovedfunksjon er å transportere oksygen fra lungene til vevene.
De første levende vesener var encellede og bodde i en flytende atmosfære som de ble næret fra og som de eliminerte avfallet sitt, så vel som noen av organismer som for tiden eksisterer. Under disse forholdene oppnås disse prosessene ved enkle formidlingsmekanismer, siden celleveggen er i intim kontakt med mediet som leverer den.
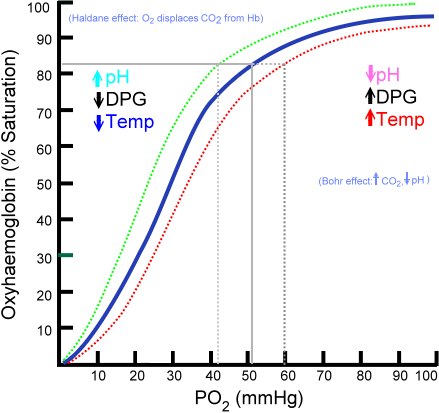
 Dissosiasjonskurve for Oxihemoglobin (Kilde: Ratznium at English Wikipedialat -versjoner ble lastet opp av AaronSharpe på IN.Wikipedia. [Public Domain] via Wikimedia Commons)
Dissosiasjonskurve for Oxihemoglobin (Kilde: Ratznium at English Wikipedialat -versjoner ble lastet opp av AaronSharpe på IN.Wikipedia. [Public Domain] via Wikimedia Commons) Utviklingen av stadig mer komplekse pluricellulære organismer antydet at indre celler ble betydelig flyttet fra miljøet, så formidlingsmekanismene ettersom den eneste forsyningskilden ble utilstrekkelig.
Dermed ble spesialiserte systemer utviklet for å oppnå næringsstoffer og gasser som fordøyelsessystemet og luftveiene, samt transportmekanismer for å bringe disse næringsstoffene og gassene til cellen: det kardiovaskulære systemet.
For å produsere energi i form av ATP -molekyler, trenger celler oksygen. Med tanke på det faktum at ATP ikke kan lagres, må den konstant syntetiseres, noe som betyr en permanent etterspørsel etter oksygen etter celler.
Hemoglobin dukket opp, evolusjonært sett, som en gasstransportør som "løser" problemet med oksygentransport fra miljøet til cellen.
[TOC]
Egenskaper og struktur
For å snakke om egenskapene og strukturen til oksyhemoglobin er det nødvendig å referere til hemoglobin, siden oksyhemoglobin ikke er noe mer enn oksygen hemoglobin. Derfor, fra nå av, vil fellesegenskapene til molekylet i nærvær eller ikke av den aktuelle gassen bli beskrevet.
Hva er hemoglobin for?
Hemoglobin er nødvendig for å transportere oksygen til vevene i mengden og hastigheten som de fortjener, med tanke på at oksygen har så lite blodløselighet at diffusjonstransporten ville være utilstrekkelig for å tilføre vevsbehov.
Kan tjene deg: bevis på evolusjonen av levende vesenerHvordan er et hemoglobinmolekyl?
Hemoglobin er et tetramerisk protein (som har fire underenheter), har en sfærisk form og en molekylmasse på 64 kDa.
Dens fire underenheter utgjør en enkelt funksjonell enhet, der hver og en gjensidig påvirker den andre. Hver underenhet er sammensatt av en polypeptidkjede, globin og en protesegruppe, hemoen eller "hem" -gruppen, som fungerer som en kofaktor og ikke dannes av aminosyrer; det vil si at det ikke er protein natur.
Globin er på to måter: Alpha Globin og Beta Globin. Hemoglobin -tetrameren består av et par alfakjeder (141 aminosyrer) og et par beta globinkjeder (146 aminosyrer).
Hver av de fire polypeptidkjedene er knyttet til en hemo -gruppe, som har et jernatom i jernholdig tilstand (Fe2+) i sentrum.
Hvordan er hemo -gruppen?
Hemo -gruppen er en porfyrinring som dannes av fire pyrroliske ringer (heterocykliske aromatiske forbindelser med formelen C4H5N) forent av metylbroer. Jernet i jernholdig tilstand som finnes i sentrum er underlagt strukturen gjennom koordinerte nitrogenkoblinger.
Hver hemo -gruppe er i stand til å bli med i et oksygenmolekyl, slik at hvert hemoglobinmolekyl bare kan gå sammen med 4 gassmolekyler.
Menneskekroppen inneholder omtrent 2,5 x 1013 erytrocytter, som er blodcellene som produserer og transporterer hemoglobin. Hver erytrocyt har omtrent 280 millioner hemoglobinmolekyler og kan deretter transportere mer enn 1000 millioner oksygenmolekyler.
Kan tjene deg: hominiseringsprosess: Kjennetegn og faserHvordan dannes oksyhemoglobin?
Oxihemoglobin dannes etter foreningen av et oksygenatom til hvert jernatom som finner i hver hemokruppe av hemoglobinmolekylet.
Begrepet oksihemoglobin refererer deretter til en oksygenert og ikke kjemisk oksidert hemoglobin, siden det ikke mister et elektron når det kombineres med oksygen og jern forblir i jernholdig tilstand.
Oksygenering gir en endring i molekylets kvartærstruktur, det vil si en endring i konformasjon som kan overføres fra globinkjedene til hemo og omvendt gruppe.
Hva er den maksimale mengden oksygen som kan laste hemoglobin?
Hemoglobin kan på det meste bli med fire oksygenmolekyler i strukturen. Hvis det molære volumet av ideelle gasser er 22.4 l/mol, en mol hemoglobin (64.500g) vil bli med 89.6 liter oksygen (4 mol O2 x 22.4 l/mol).
Så hvert gram hemoglobin må bli med 1.39 ml O2 for å være 100% mettet (89.6L/64500G X (1000ML/L)).
I praksis viser blodprøver litt lavere resultater, siden det er små mengder metemoglobin (oksidert hemoglobin) og karboksyhemoglobin (hemoglobin + karbonmonoksid (CO)) som ikke kan bli med oksygen.
Når dette tar hensyn til dette, fastslår "Hüfner" -regelen at 1G av hemoglobin i blodet har en maksimal kapasitet til å forene oksygen på 1.34ml.
Oksyhemoglobinbindingskurve
Mengden oksygenmolekyler som kan kobles til et hemoglobinmolekyl, avhenger av det delvise oksygentrykket eller PO2. I mangel av oksygen er hemoglobin deoksygenert, men når PO2 øker, øker antallet oksygen som binder seg til hemoglobin øker.
Oksygenbindingsprosessen til hemoglobin avhengig av delvis oksygentrykk. Ved grafing kalles resultatet "Oxihemoglobin Curve" og har en karakteristisk form for 's' eller sigmoid.
Kan tjene deg: taxismeAvhengig av PO2, vil hemoglobin være i en mindre eller større kapasitet til å "frigjøre" eller "levere" oksygenet den transporterer, i tillegg til å laste med dette.
For eksempel, i regionen mellom 10 og 60 mmHg trykk, får du delen med mer i påvente av kurven. I denne tilstanden kan hemoglobin lett gi store mengder O2. Dette er tilstanden som oppnås i vevet.
Når PO2 er mellom 90 og 100 mmHg (12 til 13 kPa), er hemoglobin nesten 100% mettet med O2; Og når arteriell PO2 er 60 mmHg (8 kPa) er metningen med O2 fremdeles så høy som 90%.
I lungene er dette forholdene som dominerer (trykk mellom 60 og 100 mmHg), og dette er det som gjør at hemoglobinmolekyler er tilstede i erytrocytter å lastes med oksygen.
Denne sigmoidformen som tegner Oxihemoglobin -kurven sikrer at dette proteinet oppfører seg som en utmerket lader på lungenivå, en veldig effektiv transportør i blodtrykket og en utmerket O2 -donor i vevene, i forhold til den lokale metabolske hastigheten, det vil si å kreve.
Referanser
- Fox, s. Yo. (2006). Human Physiology 9. utgave (s. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. K., Granner, d. K., Mayes, s. TIL., & Rodwell, V. W. (2014). Harpers illustrerte biokjemi. McGraw-Hill.
- Rawn, J. D. (1998). Biokjemi (1989). Burlington, North Carolina: Neil Patterson Publishers (C) N. Lalioti, CP Raptopoulou, A. Terzis, a. Panagiotopoulos, SP Perlepes, og. Manessi-Zouopa, J. Chem. Soc. Dalton Trans, 1327.
- Robert m. Berne, Matthew n. LEVY. (2001) Fysiologi. (3. utg.) Harcourt Editions, S.TIL.
- West, J. B. (1991). Fysiologisk grunnlag for medisinsk praksis. Williams & Wilkins
- « Erythropoietin (EPO) egenskaper, produksjon, funksjoner
- Dystrofinegenskaper, struktur og funksjoner »

