Isobariske prosessformler, ligninger, eksperimenter, øvelser

- 4551
- 1298
- Jonathan Carlsen
I en isobarisk prosess, Presset P av et system forblir konstant. Prefikset "ISO" kommer fra gresk og brukes til å betegne at noe forblir konstant, mens "Baros", også fra gresk, betyr vekt.
De isobariske prosessene er veldig egne i lukkede containere og i åpne områder, og er enkle å lokalisere dem i naturen. Med dette mener vi at fysiske og kjemiske forandringer er mulig på den jordiske overflaten eller kjemiske reaksjoner i åpne beholdere til atmosfæren.
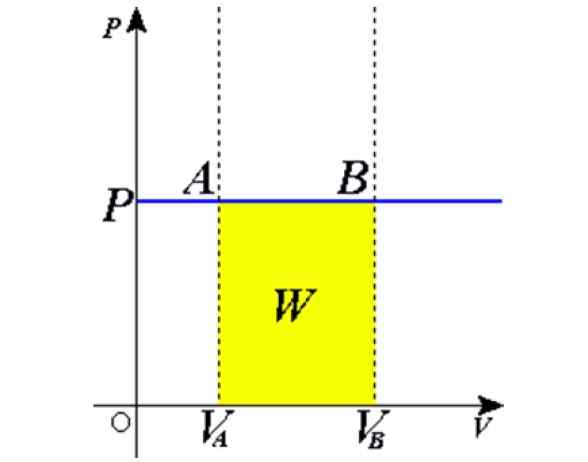 Figur 1. Isobarisk prosess: Den blå horisontale linjen er en isobara, som betyr konstant trykk. Kilde: Wikimedia Commons.
Figur 1. Isobarisk prosess: Den blå horisontale linjen er en isobara, som betyr konstant trykk. Kilde: Wikimedia Commons. Noen eksempler oppnås ved oppvarming til solen en ballong full av luft, matlaging, kokende eller frysende vann, dampen som genereres i kjelene eller prosessen med å heve en varm luftballong. Senere vil vi gi en forklaring på disse sakene.
[TOC]
Formel og ligninger
Vi utleder en ligning for den isobariske prosessen under forutsetning av at systemet som studeres er en ideell gass, en ganske passende modell for nesten hvilken som helst gass med mindre enn 3 trykkatmosfærer. De ideelle gasspartiklene beveger seg tilfeldig, okkuperer hele volumet av rommet som inneholder dem uten å samhandle med hverandre.
Hvis den ideelle gassen låst i en sylinder som er utstyrt med et bevegelig stempel, kan utvide sakte, kan det antas at partiklene til enhver tid er i balanse. Så utøver gassen på områdestempelet TIL en kraft F Omfanget:
F = s.TIL
Hvor p Det er gasstrykk. Denne styrken utøver en jobb med å produsere en uendelig forskyvning Dx I stempelet gitt av:
dw = fdx = pa.Dx
Som produktet Adx Det er et volumdifferensial Dv, så DW = PDV. Det gjenstår å integrere begge sider fra det første volumet VTIL Til det endelige volumet VB For å få det totale arbeidet som er utført av gassen:


[TOC]
Eksperimenter
Den beskrevne situasjonen er bekreftet eksperimentelt konfigurering av en gass i en sylinder forsynt med et bevegelig stempel, som vist i figur 2 og 3. Et stempel plasseres på stempelet, hvis vekt er rettet ned, mens gassen utøver en kraft opp takket være P -trykket som produserer på stempelet.
Det kan tjene deg: imantasjon: hva som består, metode og eksempler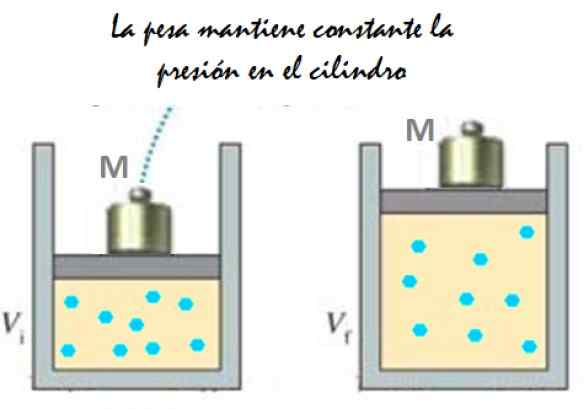 Figur 2. Eksperiment som består av å utvide en konstant trykkgass. Kilde: f. Zapata.
Figur 2. Eksperiment som består av å utvide en konstant trykkgass. Kilde: f. Zapata. Siden stempelet er i stand til å bevege seg fritt, kan volumet som gass okkuperes endres uten problemer, men trykket forblir konstant. Legge til atmosfæretrykk PATM, som også utøver en styrke ned, har du:
Mg - s.A + pATM . A = konstant
Derfor: p = (mg/a) + pATM Det varierer ikke, med mindre m og med den er vekten endret. Legger til varme til sylinderen, vil gassen utvide å øke volumet, eller den vil trekke seg sammen når den trekker ut varme.
Isobariske prosesser i den ideelle gassen
Den ideelle gassstatuslikningen relaterer viktighetsvariabler: trykk P, volum V og temperatur T:
P.V = n .R.T
Her representerer n antall føflekker og r er konstanten av de ideelle gassene (gyldig for alle gasser), som beregnes ved å multiplisere Boltzmann -konstanten med Avogadro -nummeret, noe som resulterer i:
R = 8.31 J/mol K
Når trykket er konstant, kan tilstandsligningen skrives som:
V/t = nr/p
Men nr/p er konstant, siden n, r og p er. Så når systemet går fra en stat 1 til en annen stat 2, oppstår følgende andel, også kjent som Charles 'lov:
V1/T1 = V2/T2
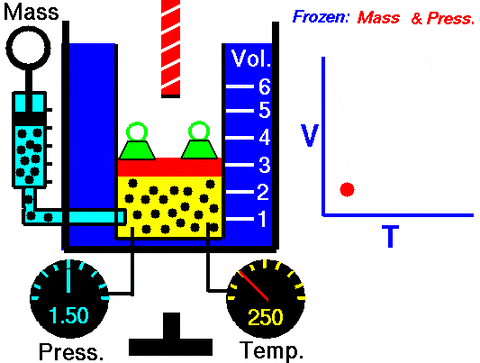 Figur 3. Animasjon som viser utvidelse av konstant trykkgass. Til høyre er grafen til volumet avhengig av temperaturen, som er en linje. Kilde: Wikimedia Commons. NASAs Glenn Research Center [Public Domain].
Figur 3. Animasjon som viser utvidelse av konstant trykkgass. Til høyre er grafen til volumet avhengig av temperaturen, som er en linje. Kilde: Wikimedia Commons. NASAs Glenn Research Center [Public Domain]. Erstatte inn W = PΔV, Arbeidet som er gjort for å gå fra tilstand 1 til 2, når det gjelder konstantene og temperaturvariasjonen, lett å måle med et termometer:
W1 → 2 = nr (t2 - T1) = nr.Δt
På den annen side fastslår den første loven om termodynamikk at:
∆u = q - w
Dette betyr at tilsetning av gassen en viss mengde varme Q, øker den indre energien ∆U og vibrasjonene av molekylene øker. På denne måten utvider gass og utfører arbeid ved å fortrenge stempelet, som vi har sagt før.
I en ideell monoatomisk gass og variasjonen av indre energi ∆U, som inkluderer både kinetisk energi og den potensielle energien til dens molekyler, er:
∆U = (3/2)Nr Δt
Til slutt kombinerer vi i ett uttrykkene vi har oppnådd:
Q = ∆u + w = (3/2)Nr Δt + Nr∆t = (5/2) Nr Δt
Alternativt kan det skrives om i form av masse m, temperaturforskjellen og en ny konstant som kalles Spesifikk varmevarme Ved konstant trykk, forkortet Cp, hvis enheter er j/mol k:
Kan tjene deg: Venus (planet)Q = m cp ∆t
Eksempler
Ikke alle isobariske prosesser utføres i lukkede containere. Faktisk oppstår utallige termodynamiske prosesser av alle slags atmosfæretrykk, så de isobariske prosessene er veldig hyppige i naturen. Dette inkluderer fysiske og kjemiske forandringer på jordens overflate, kjemiske reaksjoner i åpne åpningsbeholdere og mye mer.
For at isobariske prosesser skal skje i lukkede systemer, er det nødvendig at grensene deres er fleksible nok til å tillate endringer i volum uten trykket varierte.
Dette var det som skjedde i stempeleksperimentet som lett beveget seg når gassen utvidet. Det samme skjer ved å omslutte en gass i en fest for fester eller en varmluftsballong.
Her har vi flere eksempler på isobariske prosesser:
Kok vann og kok
Kokende vann til te eller kokesauser i åpne containere er gode eksempler på isobariske prosesser, siden alle utvikler seg ved atmosfæretrykk.
Når du varmer vannet, øker temperaturen og volumet og hvis varmen fortsettes, er kokepunktet endelig nådd, der vannfaseendringen oppstår. Mens dette skjer, forblir temperaturen også konstant på 100 ºC.
Frys vann
På den annen side er frysende vann også en isobarisk prosess, enten det finner sted i en innsjø om vinteren eller det hjemlige kjøleskapet.
Varm en ballong full av luft til solen
Et annet eksempel på den isobariske prosessen er endringen i volumet av en luftblåst ballong når den blir utsatt for solen. Første om morgenen, når det ikke er veldig varmt, har kloden et visst volum.
Når tiden går og temperaturen øker, varmer kloden også opp og øker volumet og alt dette skjer under konstant trykk. Globematerialet er et godt eksempel på grensen fleksibelt nok til å gjøre luften inni, når den er varmes opp, utvides uten å endre trykket.
Opplevelsen kan også utføres ved å justere kloden uten inflar i toppen av en glassflaske full med en tredjedel av vannet, som blir oppvarmet til Maria Bio of Mary. Så snart vannet er oppvarmet, blir ballongen oppblåst umiddelbart, men forsiktighet bør tas for ikke å varme for mye slik at den ikke eksploderer.
Den aerostatiske ballongen
Det er et flytende skip uten fremdrift, som benytter seg av luftstrømmer for å transportere mennesker og gjenstander. Globen er vanligvis fylt med varm luft, som er kaldere enn den omkringliggende luften, stiger og utvides og gjør kloden grov.
Kan tjene deg: trippelpunktMens luftstrømmer direkte til kloden, har den brennere som er aktivert for å varme opp gassen når du vil stige opp eller opprettholde høyden, og deaktiveres når du synker eller landing eller landing. Alt dette skjer ved atmosfæretrykk, antatt konstant i en viss høyde ikke langt fra overflaten.
 Figur 4. Hot luftballonger. Kilde: Pixabay.
Figur 4. Hot luftballonger. Kilde: Pixabay. Kjeler
I kjelene genereres damp ved å varme opp vann og opprettholde det konstante trykket. Da gjør denne dampen en brukbar jobb, for eksempel å generere strøm i termoelektriske planter eller handle andre mekanismer som lokomotiver og vannpumper.
Løste øvelser
Oppgave 1
Det er 40 liter gass ved 27 ° C temperatur. Finn økningen i volumet når du legger til varme isobárisk til den når 100 ºC.
Løsning
Charles lov brukes til å bestemme det endelige volumet, men oppmerksomhet: Temperaturer må uttrykkes i Kelvin, bare legg til 273 K til hver:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Fra:
V1/T1 = V2/T2 ⇒ V2 = T2(V1/T1) = 373 ºC (40 l/300 k) = 49.7 l
Endelig er volumøkningen v2 - V1 = 49.7 l - 40 l = 9.7 l.
Oppgave 2
5 leveres 5.00 x 103 J fra energi til en ideell gass for å lage 2.00 x 103 J av arbeid med miljøet ditt i en isobarisk prosess. Det blir bedt om å finne:
a) Endringen i den indre energien av gass.
b) Volumendringen, hvis nå indre energi synker med 4.50 x 103 J og 7 blir utvist.50 x 103 J av systemet, med tanke på konstant trykk på 1.01 x 105 Pa.
Løsning på
Brukt ∆u = q - w og verdiene gitt i uttalelsen erstattes: Q = 5.00 x 103 J og W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Derfor øker den indre energien av gass med 3.00 x 103 J.
Løsning b
Volumendring finnes i arbeidet utført: W = P∆V:
∆u = q - w = q - P∆V
Uttalelsen bekrefter at indre energi avtar, derfor: ∆U= -4.50 x 103 J. Den forteller oss også at en viss mengde varme blir utvist: q = -7.50 x 103 J. I begge tilfeller representerer det negative tegnet reduksjon og tap, da:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Hvor P = 1.01 x 105 Pa. Siden alle enheter er i det internasjonale systemet, er volumendringen klar:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Pa) = -2.97 x 10-2 m3
Ettersom volumendringen er negativ, betyr det at volumet avtok, det vil si at systemet ble inngått.
Referanser
- Byjou's. Isobarisk prosess. Gjenopprettet fra: Byjus.com.
- Cengel, og. 2012. Termodynamikk. 7. utgave. McGraw Hill.
- XYZ -prosess. Lær mer om den isobariske prosessen. Gjenopprettet fra: 10 -prosess.X og z.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9na red. Cengage Learning.
- Wikipedia. Gasslover. Gjenopprettet fra: er.Wikipedia.org.
- « 14 psykologiske eksperimenter med veldig kontroversielle mennesker
- Embullition -konsept, typer og eksempler »

