Hva er kjemisk kinetikk?

- 3160
- 423
- Jonathan Carlsen
Vi forklarer hva som er kjemisk kinetikk, orden og reaksjonshastighet, og faktorene som påvirker hastigheten
Hva er kjemisk kinetikk?
De Kjemisk kinetikk Det er grenen av kjemi som er ansvarlig for å studere hastigheten på kjemiske reaksjoner, hvilke faktorer som påvirker denne hastigheten og hva er de individuelle mekanismene eller trinnene som kjemiske reaksjoner oppstår.
I tillegg lar det oss forstå mange aspekter ved kjemiske reaksjoner som kjemisk balanse og aktiveringsenergi, og studerer katalyseprosesser. Det siste gjør det spesielt viktig i flere applikasjoner, fra biokjemi til industriell ingeniørfag.
I sentrum av kinetikken er reaksjonshastigheten, som kan forstås som hastigheten som reagensene blir omdannet til produkter. I Chemical Kinetics er det imidlertid en mye mer presis definisjon.
Definisjon av reaksjonshastighet
For å gi den fullstendige definisjonen av reaksjonshastigheten, som brukt i kjemisk kinetikk, la oss starte med følgende generiske kjemiske reaksjon:
I denne reaksjonen representerer A og B reagensene, C og D representerer produkter, mens A, B, C og d De representerer de respektive støkiometriske koeffisientene.
Reaksjonshastigheten (representert med symbolet v) Indikerer hvor raskt. Matematisk er dette uttrykt som følger:
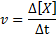
Hvor Δ [x] representerer endringen i mola konsentrasjon av arter x (a, b, c eller d) i tidsintervallet Δt.
Det er tydelig at jo raskere noen av reagensene konsumeres, jo raskere vil de andre reagensene bli konsumert og jo raskere vil produktene oppstå. Av denne grunn er det bare nødvendig å definere hastigheten i form av en av dem.
Det kan tjene deg: metoder for separasjon av homogene blandingerFor å sikre at resultatet av beregningen av hastigheten alltid er den samme, uavhengig av hvilken art hastigheten er definert, må den alltid deles mellom den støkiometriske koeffisienten og plasser et tegn mindre før ligningen hvis det er et reagens. Det er å si:
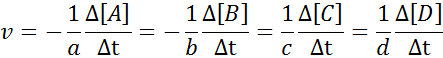
Eksempel på definisjon av reaksjonshastighet
Gitt følgende kjemiske reaksjon:
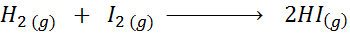
Skriv definisjonen av reaksjonshastigheten avhengig av hver involvert art.
Løsning:
I form av h2:
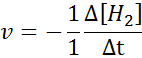
I form av i2:
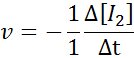
Når det gjelder hei:
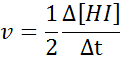
Hastighetsloven og reaksjonsrekkefølgen
Reaksjoner oppstår når atomer og molekyler kolliderer med hverandre med tilstrekkelig energi og riktig orientering. Sannsynligheten for at dette skjer øker når atomer og molekyler er mer konsentrert.
Av denne grunn avhenger hastigheten nesten alltid av konsentrasjonen av reagenser. I noen tilfeller avhenger hastigheten også av konsentrasjonen av noen av produktene, så vel som konsentrasjonen av en hvilken som helst katalysator eller hemmer som er til stede i miljøet.
Den matematiske ligningen som relaterer hastigheten på en reaksjon på konsentrasjonen av de forskjellige artene som er involvert, kalles "Hastighetslov”Og i enklere tilfeller har den følgende form:
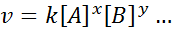
Hvor k Det er en proporsjonalitetskonstant kalt hastighetskonstant, og eksponentene til A, B og alle andre arter som vises i ligningen, kalles reaksjonsordrer.
I henhold til summen av alle reaksjonsordrer (som kalles global orden), kan forskjellige typer reaksjoner skilles ut. Disse skiller seg fra hvor mye konsentrasjonen påvirker hastigheten, i formelen for tiden det tar å konsumere halvparten av reagensene (halvliv) og i måten konsentrasjonen av reagensene endres over tid (grafene [a] vs t ).
-
Bestillingsreaksjoner 0
Når alle eksponenter i hastighetsloven er 0, reduseres ligningen for hastighetsloven til:
Kan tjene deg: koordinert kovalent lenke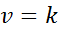
Med andre ord, de er reaksjoner som oppstår med konstant hastighet og hvor hastigheten ikke er avhengig av konsentrasjonen av noe reagens eller produkt.
Bestill grafer 0
Grafen til [a] vs t av ordrereaksjoner 0 er synkende rette linjer.
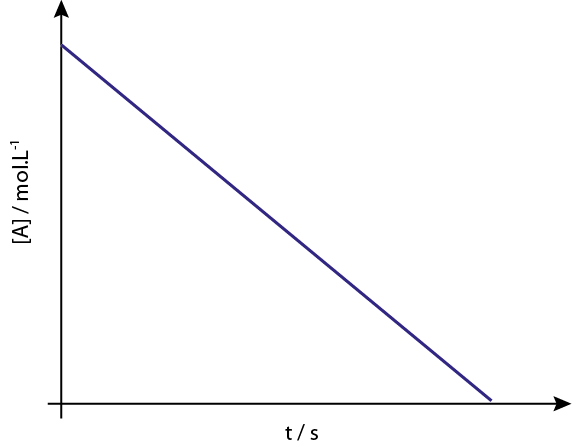
Legend: Konsentrasjonsgrafen kontra tid for en reaksjon av orden 0 gir en rett linje.
Midtliv for ordre 0
For en reaksjon av ordre 0, halvlivets tid (t1/2) Er gitt av:
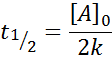
-
1. ordreaksjoner
I disse reaksjonene varierer hastigheten lineært med konsentrasjonen. Første ordenshastighetslov er:
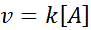
Første ordens grafikk
Grafen til [a] vs t av de første ordreaksjonene er synkende hyperbolas. Imidlertid, hvis den neperiske logaritmen for konsentrasjon (Ln [a]) vs tid er graf, oppnås en rett linje.
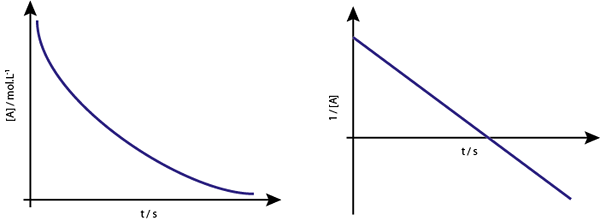 Konsentrasjonsgrafen kontra tid for en reaksjon av orden 1 gir en hyperbola, men grafen til den neperiske logaritmen til konsentrasjonen kontra tid gir en linje
Konsentrasjonsgrafen kontra tid for en reaksjon av orden 1 gir en hyperbola, men grafen til den neperiske logaritmen til konsentrasjonen kontra tid gir en linje Midtlivet for førsteordre reaksjoner
For en reaksjon av ordre 1, t1/2 Det avhenger ikke av den innledende konsentrasjonen og er gitt av:
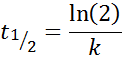
-
Andre ordens reaksjoner
En reaksjon kan være andre orden med hensyn til et enkelt reagens, eller første orden med hensyn til to reagenser. I det første tilfellet er hastighetsloven gitt av:
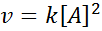
Andreordens grafikk
Grafen til [a] vs t av andre -ordensreaksjoner er synkende hyperbolas. Imidlertid, hvis det inverse av konsentrasjonen (1/[a]) vs tid er plottet, oppnås en rett linje.
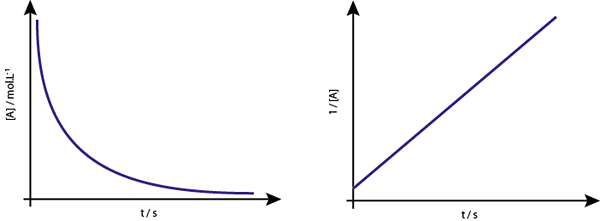 Konsentrasjonsgrafen kontra tid for en reaksjon av rekkefølge 2 gir en kurve som ligner en synkende hyperbola, men grafen til konsentrasjonen kontra tid gir en linje
Konsentrasjonsgrafen kontra tid for en reaksjon av rekkefølge 2 gir en kurve som ligner en synkende hyperbola, men grafen til konsentrasjonen kontra tid gir en linje Midtlivet for andreordens reaksjoner
For en reaksjon av ordre 2, t1/2 Er gitt av:
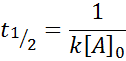
Faktorer som påvirker reaksjonshastigheten
Temperatur
Temperaturen øker alltid hastigheten som reaksjonene oppstår, siden frekvensen og energien som molekylene kolliderer med hverandre øker. Avhengigheten av reaksjonshastigheten med temperaturen er gitt av Arrhenius -ligningen.
Det kan tjene deg: magnesiumhydrid: struktur, egenskaper og brukPress
Økende trykk tilsvarer å øke konsentrasjonen av alle arter i reaksjonsmediet (for gassfase -reaksjoner), så trykkøkning har en tendens til å øke reaksjonshastigheten.
Katalysatorer
Katalysatorer er kjemiske stoffer som tilsettes mediet bare for å øke reaksjonshastigheten. De fleste katalysatorer fungerer ved å endre reaksjonsmekanismen med en som krever lavere aktiveringsenergi.
Vanlige katalysatoreksempler er enzymer i levende systemer og noen metaller som platina og paladium.
Hemmere
Inhibitorer er det motsatte av katalysatorer. De er stoffer som gjør reaksjoner saktere. Antikorrosiv er eksempler på hemmere som søker å redusere hastigheten på korrosjonsreaksjoner, for å gjøre metalloverflater mer.


