Hva er kjemisk periodisitet?
- 2067
- 91
- Daniel Skuterud
De Kjemisk periodisitet Det er en trend eller mønster som viser de kjemiske elementene for et sett med deres kjemiske og fysiske egenskaper. Det blir et slags slektskap, som var en grunnleggende guide for kjemi foreldre å organisere og klassifisere alle elementene i dagens kjente periodiske bord.
De 118 eksisterende elementene (mellom naturlig og kunstig) holder i annen grad et forhold til hverandre som definerer dem i familier eller grupper. Til å begynne med tillot dette å beskrive reaktivitetene til elementene, så vel som typen forbindelser som dannes; Og enda bedre, forutsi egenskapene til de som ennå ikke hadde blitt oppdaget.
 Elementene i det periodiske bordet
Elementene i det periodiske bordet Da, mens det tjuende århundre og fysikken gikk, ble disse egenskapene korrelert med den elektroniske strukturen til atomet. Dermed markerer elektroner kjemisk periodisitet med hensyn til elementene, men ikke så mye for isotoper og relativ stabilitet.
Takket være kjemisk periodisitet er det mulig å forstå hvorfor elementene er plassert i samme gruppe i periodisk tabell. Det muliggjør også prediksjon av kjemiske egenskaper, og til og med fysiske, blant elementer i forskjellige atommasser.
[TOC]
Mønstre og grupper
 Som de sikksakkende mønstrene til disse skyene, viser elementene til elementene en periodisk og karakteristisk tendens. Kilde: Pravin Bagga/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Som de sikksakkende mønstrene til disse skyene, viser elementene til elementene en periodisk og karakteristisk tendens. Kilde: Pravin Bagga/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Kjemisk periodisitet observeres, som forventet, i periodiske egenskaper. Disse er preget av tendensen til verdiene deres når de blir evaluert over en periodisk periode eller gruppe.
En sikksakk, en sag eller et bratt fjell kan velges til sammenligningsformål: med oppturer og nedturer. Det vil si at periodiske egenskaper varierer med minimale og maksimale for visse elementer. Og de relative posisjonene til disse elementene samsvarer, strålende, med stedet i sine respektive grupper.
Det er grunnen til at kjemisk periodisitet er nyttig for å analysere det basert på grupper; Perioder er imidlertid avgjørende for en fullstendig visjon om trenden.
Kan tjene deg: Kaliumkarbonat (K2CO3): Struktur, egenskaper, bruksområder, innhentingDet vil sees med følgende eksempler på periodisitet i kjemi, som ikke bare får i periodiske egenskaper, men også i de uorganiske forbindelsene og, inkluderende organisk.
Ioniseringsenergi
Ioniseringsenergi, er, er en av de mest fremragende periodiske egenskapene. Jo større atomet i et element er, desto lettere vil det være å fjerne; det vil si de fra Valencia. Derfor: atomer med små radioer vil ha store, mens atomer med store radioer, de vil ha små.
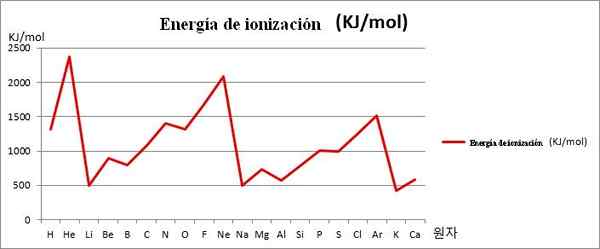 EI vs. grafikk. De første 20 kjemiske elementene. Kilde: Kenneth.JH.Han/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
EI vs. grafikk. De første 20 kjemiske elementene. Kilde: Kenneth.JH.Han/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Legg merke til for eksempel på bildet over at elementene Li, Na og K, har mindreårige EI, og det er grunnen til at de ligger i dalene eller midlene til grafikken. I mellomtiden finnes elementene han, NE og AR, på toppene eller høyere punkter, siden deres er veldig store i forhold til de andre elementene.
Elementene Li, Na og K tilhører gruppen av alkaliske metaller, preget av deres EI -havari. På den annen side tilsvarer elementene han, NE og AR de edle gassene, med veldig høye, fordi atomene deres er de minste blant alle elementene i samme periode av det periodiske bordet.
Dermed indikerer kjemisk periodisitet at den avtar ned en gruppe, men øker tur på en periode fra venstre til høyre.
Blokkerer hydros p
Et eksempel på den kjemiske periodisiteten utenfor de periodiske egenskapene vi ser i hydrorene til blokkelementene p.
For eksempel er gruppe 15 sammensatt av elementer N, P, AS, SB og BI. Hvis det er kjent at ammoniakk, NH3, Det har nitrogenet med et oksidasjonsnummer på +3, da er det mulig å forvente, ved enkel periodisitet, at de gjenværende elementene også har lignende hydros. Og faktisk er det: NH3, Ph3, Aske3, Sbh3 og Bih3.
Kan tjene deg: bor: historie, egenskaper, struktur, brukEn annen lignende sak oppstår med gruppe 16. Oksygenhydrid er h2Eller, vann. Det forventes igjen at elementene S, Se, TE og Po har hydror med like formler, men med avgrenset forskjellige egenskaper. Og det er: h2S, h2Se, h2Te og h2Po. Dette skyldes kjemisk periodisitet.
Det kanskje mest imponerende eksemplet forstås av karbon, silisium og germanium hydros. Karbonhydrid er Cho4, Og silisium, sih4. Germanio, spådd av Mendeleev med navnet Eka-Silicio (ES), må ha som en periodisitet en hydrid med Geh-formel4; spådom som endte opp med å bekrefte etter oppdagelsen og påfølgende studier.
Halogenmolekyler
Hvis det er kjent at fluor er i elementær tilstand som et M -molekyl2, Da antas det at de andre halogenene (Cl, BR, I og AT) også danner diatomiske molekyler. Og det vil si å være CL -molekylene2, Br2 og jeg2 Den best kjente.
Oksider og sulfider
Tilsvarende som nevnt med blokkhydror p, Oksider og sulfider for elementer i samme gruppe viser en slags korrespondanse i sine respektive kjemiske formler. For eksempel er litiumoksid Li2Eller å være oksider for andre alkaliske metaller eller gruppe 1: NA2GREIT2Eller, RB2O og CS2ENTEN.
Dette er fordi metallene i alle av dem med et oksidasjonsnummer på +1, samhandler med en anion eller2-. Det samme skjer med sulfidene sine: li2S, na2S, etc. Når det.
Det kan tjene deg: selenary acid (H2SO3): Egenskaper, risikoer og bruksområderDenne periodisiteten gjelder også (delvis) for oksydene til blokkelementene p: Co2, Sio2, Geo2, B2ENTEN3, Til2ENTEN3, Ga2ENTEN3, etc. For blokkeringselementer d eller andre av blokken p, Denne periodisiteten blir mer komplisert på grunn av høyest mulig oksidasjonstall for det samme elementet.
For eksempel tilhører kobber og sølv gruppe 11. Den ene har to oksider: Cuo (Cu2+) og Cu2Eller (cu+); Mens den andre knapt bare har en: siden (AG+).
Hydrokarboner og silaner
Både karbon og silisium har henholdsvis muligheten til å danne C-C eller Si-Si-bindinger. C-C-bindinger er mye mer stabile, slik.
Denne konklusjonen skyldes igjen kjemisk periodisitet. For eksempel etan, cho3Ch3 eller c2H6 Disilanum har sin motpart, sih3Ja H3 eller hvis2H6.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Helmestine, Anne Marie, PH.D. (26. august 2020). Periody Definisjon i kjemi. Gjenopprettet fra: Thoughtco.com
- OG. V. Babaev, & Ray Hefferlin. (s.F.). Konsept med kjemisk periodisitet:
Fra Mendeleev Molecular Table Hyper-Periodicity Patterns. Gjenopprettet fra: Chem.MSU.Ru - Blomster s., Theopold k., & Langley r. (s.F.). Periody. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Det åpne universitetet. (2020). Kjemiske mønstre er å finne i periodetabellen: kjemisk periodisitet. Gjenopprettet fra: Åpne.Edu

