Chimotripsin -egenskaper, struktur, funksjoner, virkningsmekanisme
- 4447
- 517
- Prof. Joakim Johansen
De Chimotripsin Det er det nest mest tallrike fordøyelsesproteinet av bukspyttkjertelen mot tynntarmen. Det er et enzym som tilhører familien til serin-proteasene og spesialiserer seg på hydrolyse av peptidbindingene mellom aminosyrer som tyrosin, fenylalanin, tryptofan, metodin og leukin til stede i stort protein.
Navnet "Chemotripsin" samler faktisk en gruppe enzymer som produseres av bukspyttkjertelen og som aktivt deltar i tarm fordøyelse av proteiner hos dyr. Ordet stammer fra reninaksjonen som dette enzymet har på gastrisk innhold eller "Chimo".
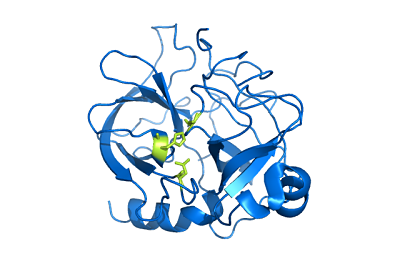
 Chimotripsin Structure (Kilde: Bruker: Mattyjenjen [attribusjon] via Wikimedia Commons)
Chimotripsin Structure (Kilde: Bruker: Mattyjenjen [attribusjon] via Wikimedia Commons) Selv om det ikke er kjent nøyaktig hvor bred fordelingen er i dyreriket, anses det at disse enzymene er i det minste i alle lammene, og det er rapporter om deres tilstedeværelse i "mer primitive kanter" som leddyrene og den av av Celastroads.
Hos de dyrene som har bukspyttkjertel, er et slikt organ hovedstedet for chimotripsineproduksjon, så vel som andre proteaser, enzymatiske hemmere og forløpere eller zimogener.
Chimotripsins er de mest studerte og bedre karakteriserte enzymer, ikke bare i forhold til deres biosyntese, men også med deres aktivering fra zimogen, dens enzymatiske egenskaper, dens hemming, dens kinetiske og katalytiske egenskaper og dens generelle struktur.
[TOC]
Egenskaper og struktur
Chimotripsins er endopeptidaser, det vil si at de er proteaser som hydrolyserer peptidbindinger av aminosyrer i "indre" posisjoner av andre proteiner; Selv om det også er vist at de kan hydrolysere estere, amidas og arilamidas, selv om det med mindre selektivitet.
De har en gjennomsnittlig molekylvekt på omtrent 25 kDa (245 aminosyrer) og produseres fra forløpere som er kjent som kjemotripsinogener.
Fra bukspyttkjertelen til bovine dyr er 2 typer kjemotripsinogener blitt renset, A og B. I grisemodellen ble en tredje kjemotripsinogen. Hver av disse tre zimogenene er ansvarlige for produksjonen av henholdsvis chimotropsins A, B og C.
Det kan tjene deg: Quintana Roo Flora og FaunaChimotripsin A dannes av tre polypeptidkjeder som er kovalent knyttet til hverandre gjennom broer eller disulfidbindinger mellom cysteinrester. Det er imidlertid viktig å nevne at mange forfattere anser det som et monomer enzym (sammensatt av en enkelt underenhet).
Disse kjedene utgjør en struktur som har en ellipsoidform, der grupper som har elektromagnetiske belastninger er plassert mot overflaten (bortsett fra aminosyrer som deltar i katalytiske funksjoner).
Generelt er sjimotropsiner ekstremt aktive til syre pH, selv om de som er blitt beskrevet og renset fra insekter og andre ikke -virveldyr er stabile ved pH mellom 8 og 11 og ekstremt ustabile for å senke pH.
Chemotripsin fungerer
Når den eksokrine bukspyttkjertelen stimuleres, enten det er av hormoner eller av elektriske impulser, frigjør dette organet sekretoriske granuler rikt på kjemotripsinogen, som en gang når tynntarmen, kuttes av en annen protease mellom avfall 15 og 16 og deretter er "auto tiltalt" for å utføre en helt aktivt protein.
Kanskje er hovedfunksjonen til dette enzymet å handle sammen med de andre utskillede proteasene mot gastrointestinalsystemet for fordøyelsen eller nedbrytningen av proteinene som konsumeres med mat.
Produktene fra slik proteolyse fungerer deretter som en kilde til karbon og energi gjennom aminosyrekatabolisme eller kan "resirkuleres" direkte for dannelse av nye celleproteiner som vil utøve flere og varierte funksjoner på fysiologisk nivå.
Virkningsmekanismen
Chimotripsins utøver sine handlinger bare etter å ha blitt aktivert, da disse produseres som "forløper" (zimogen) former kalt cellegift.
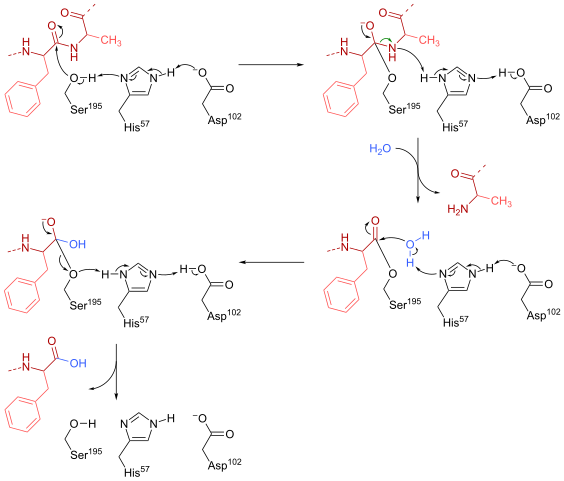 Quimotripsin reaksjonsmekanisme (kilde: HBF878 [CC0] via Wikimedia Commons)
Quimotripsin reaksjonsmekanisme (kilde: HBF878 [CC0] via Wikimedia Commons) Opplæring
Zimogenene av chimotripsin syntetiseres av acinarcellene i bukspyttkjertelen, hvoretter de vandrer fra endoplasmatisk retikulum til Golgi -komplekset, hvor de er pakket i membraneksomplekser eller sekretoriske granuler.
Kan tjene deg: vitenskaper som er relatert til biologiDisse granulatene akkumuleres i endene av acinos og frigjøres som svar på hormonelle stimuli eller nerveimpulser.
Aktivering
Avhengig av aktiveringsbetingelsene, kan det finnes flere typer chimotripsiner.
Aktiveringsreaksjonen består opprinnelig av skjærebindingen mellom aminosyrene 15 og 16 i chimotripsinogenet, som danner π-quimotripsin, i stand til "selvprosess" og fullstendig autokatalyseaktivering.
Handlingen til dette siste enzymet fremmer dannelsen av etter peptider sammen ved hjelp av den C-terminale kjeden, som begynner med rest 149).
Delene som tilsvarer avfall 14-15 og 147-148 (to dipéptider) har ingen katalytiske funksjoner og løsner fra hovedstrukturen.
Katalytisk aktivitet
Chimotripsin er ansvarlig for hydrolyserende peptidbindinger, og angrep hovedsakelig den karboksyliske delen av aminosyrer som har aromatiske laterale grupper, det vil si aminosyrer som tyrosin, tryptofan og fenylalanin.
En serine (å være 195) på det aktive stedet (Gly-Asp-serie-Gly-Glu-Ala-Val) av denne typen enzymer er kanskje den mest essensielle resten for dens drift. Reaksjonsmekanismen er som følger:
- Chimotripsin er opprinnelig funnet i en "substratfri" form, der den katalytiske "triaden" består av den laterale karboksylgruppen til en aspartatrester (102), imidazolringen til en histidinrest (57) og gruppesidenhydroksyl av A Serine (195).
- Underlaget møter enzymet og blir sammen med dette for å danne et typisk enzym-substrat reversibelt kompleks (i henhold til den micaelian-modellen), der den katalytiske "triaden" letter det nukleofile angrepet ved å aktivere hydroksylgruppen til serinen til serin.
Det kan tjene deg: Nitrogenbaser: Hva er, klassifisering, funksjoner- Nøkkelpunktet i reaksjonsmekanismen består i dannelsen av en delvis kobling, noe som resulterer i polarisering av hydroksylgruppen, som er tilstrekkelig til å akselerere reaksjonen.
- Etter det nukleofile angrepet blir karboksylgruppen en tetrahedral oksianion -mellomledd, som er stabilisert av to hydrogenbroer dannet av grupper N og H av GLY -resten 193 og er 195.
- Oxyanion er spontant "omorganiserende" og en enzymatisk mellomledd dannes som en acylgruppe er tilsatt (acyled enzym).
- Reaksjonen fortsetter med inntreden av et vannmolekyl til det aktive stedet, et molekyl som fremmer et nytt nukleofilt angrep som resulterer i dannelsen av et andre tetrahedrale mellomledd som også er stabilisert ved hydrogenbroer.
- Reaksjonen slutter når denne andre mellomledningen omorganiseres igjen og danner igjen etzym-substrat micaelian-komplekset, der det aktive stedet for enzymet er okkupert av produktet som er inneholdt i karboksylgruppen.
Referanser
- Appel, w. (1986). Chymotrypsin: Molekylære og katalytiske egenskaper. Clinical Biochemistry, 19 (6), 317-322.
- Bender, m. L., Killheffer, J. V., & Cohen, S. (1973). Chymotrypsin. CRC kritiske anmeldelser i biokjemi, 1 (2), 149-199.
- Blow, d. M. (1971). 6 Strukturen til chymotrypsin. I enzymene (volum. 3, s. 185-212). Akademisk presse.
- Blow, d. M. (1976). Struktur og mekanisme for chymotrypsin. Regnskap for kjemisk forskning, 9 (4), 145-152.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.
- Polgár, l. (2013). Katalytiske mekanismer for serin- og treoninpeptider. I håndbok av proteolytiske enzymer (PP. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hypotese for virkningsmekanismen til chymotrypsin. Proceedings of the National Academy of Sciences of the United States of America, 43 (11), 969.
- « Benzylsyresyntese, transponering og bruk
- Visuelle læringsegenskaper, strategier, aktiviteter, eksempler »

