Atomisk radio
- 2985
- 376
- Anders Mathisen
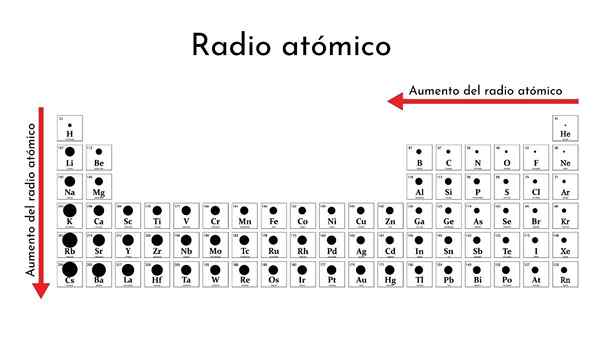
 Periodisk tabell over elementene med atomradioer
Periodisk tabell over elementene med atomradioer Hva er atomradioen?
Han Atomisk radio Det er en viktig parameter for de periodiske egenskapene til elementene i den periodiske tabellen. Det er direkte relatert til atomerens størrelse, siden større radio, større eller klumpete er. På samme måte er det relatert til de elektroniske egenskapene til det samme.
Mens et atom har flere elektroner, desto større er atomstørrelse og radio. Begge er definert av elektronene i Valencia -laget, fordi i avstander utenfor banene deres, nærmer sannsynligheten for å finne et elektron nærmer seg null. Det motsatte skjer i nærheten av kjernen: sannsynligheten for å finne et elektron økes.
 Bomullskulepakke. Måten de er komprimert på, definerer størrelsen og radioene på, på samme måte som skjer med atomer
Bomullskulepakke. Måten de er komprimert på, definerer størrelsen og radioene på, på samme måte som skjer med atomer Det øvre bildet representerer en bomullskuleemballasje. Merk at hver og en er omgitt av seks naboer, og teller ikke en annen mulig eller nedre rad. Måten bomullskuler er komprimert på, vil definere størrelsene og derfor deres radioer; Som med atomer.
Elementene i henhold til deres kjemiske natur samhandler med sine egne atomer på en eller annen måte. Derfor varierer størrelsen på atomradius i henhold til typen binding og med den faste emballasjen til dens atomer.
Hvordan måles atomradius?
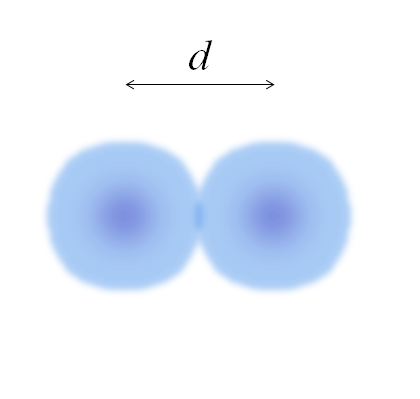 Bilde av to atomer, hvis kanter ikke er helt definert. Kilde: Gabriel Bolívar
Bilde av to atomer, hvis kanter ikke er helt definert. Kilde: Gabriel Bolívar I det forrige bildet kan det være enkelt. Imidlertid er ikke et atoms sfære. Fordi? Fordi elektroner sirkulerer og uskarpe i betongregioner i rom: orbitaler.
Derfor kan atomet betraktes som en sfære med impalpable kanter, som det er umulig å si med sikkerhet hvor de slutter. I det overordnede bildet ser for eksempel regionen av sentrum, nær kjernen, en mer intens farge, mens kantene er uskarpe.
Kan tjene deg: solvasjonBildet representerer et diatomisk molekyl og2 (Som CL2, H2, ENTEN2, etc.). Forutsatt at atomer er sfæriske kropper, hvis avstanden ble bestemt d Det skiller begge kjerner i den kovalente koblingen, det ville da være nok til å dele den i to halvdeler (d/2) for å oppnå atomradius; mer presist, den kovalente radien til E for E2.
Hva om E ikke dannet kovalente bindinger med seg selv, men det var et metallisk element? Så d Det vil være indikert av antall naboer som omgir E i metallstrukturen; det vil si av koordineringsnummeret (n.C) av atomet inne i emballasjen (husk bomullsballene på bildet).
Bestemmelse av internukleær avstand
Å bestemme d, som er den internukleære avstanden for to atomer i et molekyl eller emballasje, kreves fysiske analyseteknikker.
En av de mest brukte er x -ray diffraksjon. Det utstråler en lysstråle gjennom et glass, og diffraksjonsmønsteret som følge av interaksjonene mellom elektroner og elektromagnetisk stråling blir studert.
Avhengig av emballasjen, kan forskjellige diffraksjonsmønstre oppnås og derfor andre verdier av d.
Hvis atomene er "stramme" i det krystallinske nettverket, vil de presentere forskjellige verdier av d Sammenlignet med de som ville ha gjort hvis de var "komfortable".
På samme måte kan disse internukleære avstandene variere fra verdier, slik at atomradius faktisk består av en gjennomsnittsverdi av slike målinger.
Hvordan relaterer atomradius og koordinasjonsnummer? V. Goldschmidt etablerte et forhold mellom de to, der for en n.C på 12, er den relative verdien 1; av 0.97 for emballasje der atomet har n.C lik 8; av 0.96, for en n.C lik 6; og 0.88 for en n.C av 4.
Kan tjene deg: natrium permanganat (namno4): egenskaper, risikoEnheter
Fra verdiene for n.C Lik 12, er det bygget mange av tabellene der atomradioene til alle elementene i den periodiske tabellen sammenlignes.
Som ikke alle elementer danner slike kompakte strukturer (n.C Mindre enn 12) brukes V -forholdet. Goldschmidt for å beregne atomradioene sine og uttrykke dem for samme pakking. På denne måten er målingene av atomradioer standardiserte.
Men hvilke enheter som kommer til uttrykk i? Gitt d Det er av veldig liten størrelse, enhetene til Angstrom Å (10 ∙ 10-10m) eller også mye brukt, picometer (10 ∙ 10-12m).
Hvordan endrer du deg i den periodiske tabellen?
Over en periode
Atomradioene som er bestemt for metallelementer kalles metallradioer, mens for de ikke -metalliske elementene, kovalente radioer (som fosfor, p4, eller svovel, s8). Mellom begge typer radioer er det imidlertid et mer fremtredende skille enn navnet.
Fra venstre mot høyre i samme periode tilfører kjernen protoner og elektroner, men sistnevnte er begrenset til samme energinivå (hovedkvantumnummer).
Som en konsekvens utøver kjernen en økende effektiv kjernefysisk belastning på valenselektroner, som kontrakter atomradius.
På denne måten har ikke -metalliske elementer i samme periode en tendens til å ha mindre atomiske (kovalente) radioer.
Synkende av en gruppe
Når du synker av en gruppe, blir nye energinivåer aktivert, som lar elektroner ha mer plass. Dermed dekker den elektroniske skyen større avstander, den uskarpe periferien ender mer fra kjernen, og derfor utvides atomradius.
Kan tjene deg: hydroksylgruppeLantanide sammentrekning
Elektronene i det indre laget er med på å skinne den effektive kjernefysiske belastningen på valenselektronene. Når orbitalene som utgjør de indre lagene har mange "hulker" (noder), som med f -orbitalene, kontrakter kjernen den atomradius på grunn av den dårlige skjermffekten av dem.
Dette faktum er bevist i lantanidsammendraget i periode 6 i det periodiske bordet. Fra HF er det en betydelig sammentrekning av atomradiusproduktet fra orbitalene f, som er "fylt" som blokken F: den for Lantanoides og aktinoider blir reist.
En lignende effekt kan også observeres med elementene i blokk P fra periode 4. Dette tids produkt av den svake skjermingseffekten av D -orbitalene som fylles ved å reise periodene med overgangsmetaller.
Eksempler på atomradioer
I periode 2 i den periodiske tabellen er atomradioene til elementene:
-Li: 257 pm
-Være: 232 pm
-B: 208
-C: 197
-N: 74 pm
-O: 18.00
-F: 64 pm
Merk at litiummetallet har den største atomradius (257 pm), mens fluor, som ligger i høyre ende av perioden, er den minste av dem alle (kl. 18.00). Atomradius stiger ned fra venstre mot høyre i samme periode, og oppføringsverdiene viser det.
Litium, ved å danne metallbindinger, er radius metallisk; og fluor, som form kovalente bindinger (F-F), er radius kovalent.
Hva om du vil uttrykke atomradioer i Angstrom -enheter? Det vil være nok å dele dem med 100: (257/100) = 2.57Å. Og så videre med resten av verdiene.
Referanser
- Kjemi 301. Atomiske radier. Gjenopprettet fra: CH301.CM.UTEXAS.Edu
- CK-12 Foundation (2016). Atomradius. Gjenopprettet fra: Chem.Librettexts.org
- Trender i atomradier. Hentet fra: intro.Chem.Okstate.Edu
- Clackamas Community College (2002). Atomstørrelse. Hentet fra: DL.Clackamas.Edu
- Clark J. (2012). Atomisk og ionisk radius. Gjenopprettet fra: Chemguide.co.Storbritannia
- Shiver & Atkins. (2008). Uorganisk kjemi (fjerde utgave, p. 23, 24, 80, 169). Mc Graw Hill.

