Eksergoniske reaksjonsegenskaper og eksempler

- 4134
- 490
- Jonathan Carlsen
EN eksergonisk reaksjon Det er en som oppstår spontant, og som generelt er ledsaget av en frigjøring av energi, enten i form av varme, lys eller lyd. Når det frigjøres varme, sies det at vi står overfor en eksoterm og eksergonisk reaksjon.
Det er grunnen til at de 'eksotermiske' og 'eksergoniske' begrepene er forvirrede, og blir feilaktig behandlet som synonymer. Dette er fordi mange eksotermiske reaksjoner også er eksergoniske. Derfor, hvis en stor løsrivelse av varme og lys blir observert, for eksempel opprinnelsen til en brann, kan det antas at den består av en eksergonisk reaksjon.
 Treforbrenning er et eksempel på en eksoteremisk og samtidig eksergonisk reaksjon. Kilde: Pixnio.
Treforbrenning er et eksempel på en eksoteremisk og samtidig eksergonisk reaksjon. Kilde: Pixnio. Imidlertid kan energien som frigjøres gå upåaktet hen og ikke være så overraskende. For eksempel kan et flytende medium varme opp litt og ennå ikke være en konsekvens av en eksergonisk reaksjon. I noen eksergoniske reaksjoner som går for sakte, observeres ikke den laveste temperaturøkningen.
Det sentrale og karakteristiske punktet for denne typen termodynamiske reaksjoner er reduksjonen i Gibbs gratis energi i produkter med hensyn til reagenser, som oversettes til spontanitet.
[TOC]
Kjennetegn på eksergoniske reaksjoner
Generelt diagram
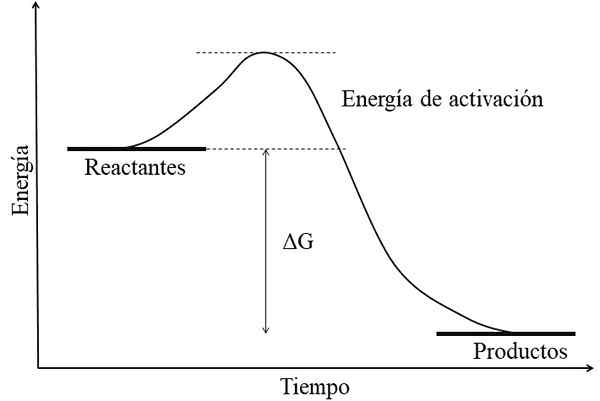 Energisiagram for en eksergonisk reaksjon. Kilde: Gabriel Bolívar.
Energisiagram for en eksergonisk reaksjon. Kilde: Gabriel Bolívar. Hovedkarakteristikken ved en eksergonisk reaksjon er at produktene har frie energier til GIBS -er lavere enn reaktanter eller reagenser (overlegen bilde). Dette faktum er vanligvis assosiert med produktene er kjemisk mer stabile, med sterkere koblinger, mer dynamiske strukturer eller mer "komfortable" forhold.
Derfor er denne energiforskjellen, ΔG, negativ (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Kan tjene deg: homogent systemAlle disse variablene som reagerer på fenomenets natur eller den kjemiske reaksjonen som vurderes, tillater å bestemme om en reaksjon vil være eksergonisk eller ikke. Og det vil også sees at det ikke nødvendigvis trenger å være en eksoterm reaksjon.
Når aktiveringsenergien er veldig høy, krever reaktantene hjelp av en katalysator for å redusere nevnte energibarriere. Det er grunnen til at det er eksergoniske reaksjoner som er gitt i veldig lave hastigheter, eller som ikke forekommer i det hele tatt i utgangspunktet.
Gratis energi reduksjon i systemet
Følgende matematisk uttrykk omfatter det som er kommentert ovenfor:
ΔG = ΔH - TΔS
Begrepet ΔH er positivt hvis det er en endotermisk reaksjon, og negativ hvis det er eksotermisk. Hvis vi vil at ΔG skal være negativt, må begrepet Tδs være veldig stort og positivt, slik at når du trekker til Δh, er resultatet av operasjonen også negativt.
Derfor, og dette er et annet spesielt kjennetegn ved eksergoniske reaksjoner: de innebærer en stor endring i systementropi.
Når vi tar hensyn til alle vilkårene, kan vi være til stede før en eksergonisk reaksjon, men samtidig endotermisk; det vil si med Δh positiv, en veldig høy temperatur, eller en endring av stor entropi.
De fleste eksergoniske reaksjoner er også eksotermiske, fordi hvis ΔH er negativ, og ved å trekke fra et annet enda mer negativt begrep, vil vi følgelig ha en ΔG med negativ verdi; Med mindre TΔS er negativ (entropi synker), og derfor vil den eksotermiske reaksjonen bli endogonisk (ikke spontan).
Det er viktig å fremheve at spontaniteten til en reaksjon (enten eksergonisk eller ikke), avhenger veldig av de termodynamiske forholdene; Mens hastigheten den passerer, skyldes kinetiske faktorer.
Det kan tjene deg: levende materie: konsept, egenskaper og eksemplerSpontanitet av en eksergonisk reaksjon
Det som har blitt sagt er kjent siden en eksergonisk reaksjon er spontan, enten eksotermisk. For eksempel kan en forbindelse oppløses i vannkjøling av den sammen med beholderen. Denne oppløsningsprosessen er endotermisk, men når den skjer spontant, sies det at den er eksergonisk.
Eksoterm reaksjon
Det er "mer eksergoniske" reaksjoner enn andre. For å finne ut av det, skal følgende uttrykk være for hånden:
ΔG = ΔH - TΔS
De mest eksergoniske reaksjonene er de som er spontant gitt til alle temperaturer. Det vil si, uavhengig av verdien av T i det forrige uttrykket, er ΔH negativ og ΔS positiv (ΔH 0). De er derfor veldig eksotermiske reaksjoner, noe som ikke motsier den første ideen.
Det kan også være eksotermiske reaksjoner der systementropi avtar (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endoterm reaksjon
På den annen side er det reaksjoner som bare er spontane ved høye temperaturer: når ΔH er positive og ΔS positive (ΔH> 0 og ΔS> 0). Vi snakker om endotermiske reaksjoner. Det er grunnen til at temperaturforekyster kan oppstå spontant, fordi de har en økning i entropi.
I mellomtiden er det reaksjoner som ikke er eksergoniske i det hele tatt: når ΔH og Δs har positive verdier. I dette tilfellet, uansett temperatur, vil reaksjonen aldri oppstå spontant. Vi snakker da, om en slutt -spontan endary reaksjon.
Kan tjene deg: SpredningsfaseEksempler på eksergoniske reaksjoner
Kjemi er vanligvis preget av å være eksplosiv og strålende, så det antas at de fleste reaksjoner er eksotermiske og eksergoniske.
Forbrenning
Eksergoniske reaksjoner er forbrenningene av alkaner, olefiner, aromatiske hydrokarboner, sukker, etc.
Metalloksidakser
På samme måte er metalloksidasjoner eksergoniske, selv om de passerer saktere.
Katabolske reaksjoner av organismen
Imidlertid er det andre mer subtile prosesser, som også er eksergoniske og veldig viktige: de katabolske reaksjonene i vår metabolisme. Her dekomponerer makromolekyler som fungerer som energireservoarer, og frigjør seg i varme og ATP, og takket være at kroppen utfører mange av funksjonene.
Den mest emblematiske av disse reaksjonene er cellulær respirasjon, motsatt av fotosyntesen, der karbohydrater med oksygen er "brent" for å transformere dem til små molekyler (CO2 og h2O) og energi.
Andre
Blant andre eksergoniske reaksjoner har vi den eksplosive nedbrytningen av nitrogentriyoduro, eller3; tilsetning av vannalkalinmetaller, etterfulgt av en eksplosjon; Polymersyntese av etoksylerte harpikser; syre-base nøytraliseringer i vandig løsning; og selvlysende cellegift.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Walter J. Moore. (1963). Fysisk kjemi. I kjemisk kinetikk. Fjerde utgave, Longmans.
- Iran. Levine. (2009). Prinsipper for fysikjemi. Sjette utgave, side 479-540. Mc Graw Hill.
- Wikipedia. (2020). Eksergonisk reaksjon. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (16. september 2019). Endergonic vs eksergonisk reaksjon og prosess. Gjenopprettet fra: Thoughtco.com
- Eksergonisk reaksjon: Definisjon og eksempel. (18. september 2015). Gjenopprettet fra: Studie.com
- Khan Academy. (2018). Gratis energi. Gjenopprettet fra: er.Khanacademy.org
- « Mekaniske energiformler, konsept, typer, eksempler, øvelser
- Bærekraftig forbruk for hva som er bruk, betydning, handlinger, eksempler »

