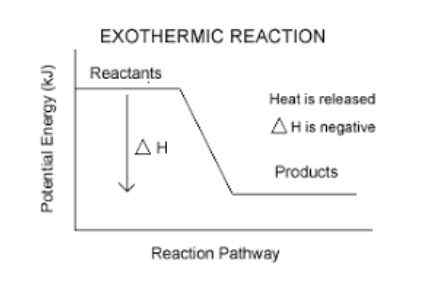
Eksoterm reaksjon
- 1298
- 301
- Markus Fredriksen
Vi forklarer hva eksotermiske reaksjoner, deres egenskaper, forskjeller med endotermiske reaksjoner er og gir flere eksempler
Hva er eksotermiske reaksjoner?
De eksotermiske reaksjoner De er kjemiske reaksjoner som frigjør energi i form av varme. Det eksotermiske ordet dannes av ""EXO"" som betyr "ute", og "Termos" Noe som betyr varme, så "eksoterm reaksjon" betyr bokstavelig talt, reaksjon der varmen går ut.
Disse reaksjonene er veldig vanlige, og vi kan finne dem overalt, fra våre hjem til cellene som er en del av kroppen vår.
Hjemme kan vi finne dem på kjøkkenet når gassen brenner i hornet for å koke maten vår. Vi finner dem også inne i bilmotorer når de brenner drivstoff.
 Et eksempel på eksotermisk reaksjon
Et eksempel på eksotermisk reaksjon På den annen side er eksotermiske reaksjoner essensielle for livet, siden de gir celler energien de trenger for å leve, vokse og reprodusere.
Kjennetegn på eksotermiske reaksjoner
De frigjør energi i form av varme
Dette er hovedkarakteristikken som gjør dem til eksoterte reaksjoner.
Den frigjorte energien kommer fra de samme reagensene
Hver kjemisk reaksjon krever at noe aktiveringsenergi oppstår. Når det gjelder eksotermiske reaksjoner, kommer denne energien fra de samme reagensene når de blir omgjort til produkter.
Eksotermiske reaksjonsprodukter er alltid mer stabile enn reagenser.
Reagensene ved å bli produkter, mister en del av energien i form av varme. Av denne grunn forblir produkter alltid med mindre energi enn reagenser, noe som gjør dem mer stabile.
De har en negativ entalpi -variasjon.
Dette er en enkel måte å vite om en reaksjon er eksoterm eller ikke. Enhver reaksjon som har en AH (les Delta H) negativ, vil være eksotermisk.
- For eksempel, Forbrenningsreaksjonen til butanen (gassen som vi brenner på kjøkkenet) har en entalpi -variasjon på -11.823 kcal/mol. Derfor er det en eksoterm reaksjon.
De trenger bare en trigger for å skje i de fleste tilfeller.
Mange eksotermiske reaksjoner trenger bare noe som gir dem nok energi til å starte. Etter dette er den samme varmen som de slipper nok til å holde reaksjonen.
- For eksempel, Ved å brenne gass er det bare en gnist som trengs, så fortsetter flammen å slå på til gassen er over.
Forskjeller mellom eksotermiske reaksjoner og endotermiske reaksjoner
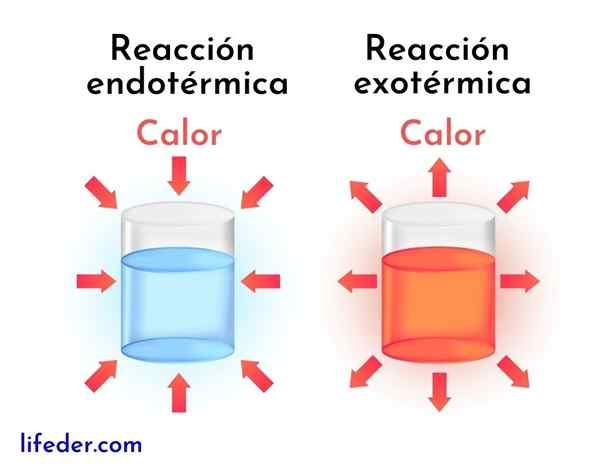
Eksotermiske reaksjoner er det motsatte av endotermiske reaksjoner. I sistnevnte absorberer reagenser energi i form av varme i stedet for å frigjøre den, som i eksotermiske reaksjoner.
Deretter presenteres hovedforskjellene mellom eksotermiske og endotermiske reaksjoner:
Eksotermiske reaksjoner | Endotermiske reaksjoner |
De frigjør energi i form av varme. | De absorberer energi i form av varme. |
De har en negativ entalpi -variasjon, det vil si DH<0. | De har en positiv entalpi -variasjon, det vil si DH> 0. |
De har en tendens til å øke temperaturen rundt. | De har en tendens til å redusere temperaturen eller avkjøles. |
Energien som holder reaksjonen som går kommer fra de samme reagensene. | Energien som holder reaksjonen går fra omgivelsene. |
Mer stabile produkter oppnås alltid med mindre energi. | Mindre stabile produkter oppnås alltid med et høyere energinivå. |
Eksempler på eksotermiske reaksjoner
Forbrenning av kjøkkengass
I de fleste av hjemmene i verden er gassen som brukes til å lage mat butan, som har molekylformelen C4H10. Dette hydrokarbonet brennes med oksygenet i luften ved hjelp av neste forbrenningsreaksjon som frigjør store mengder varme:
Kan tjene deg: enkelt mikroskop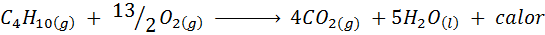
Eksplosjonen av dynamitt
Dynamitt inneholder et eksplosivt kalt nitroglyserin (C3H5N3ENTEN9). Denne forbindelsen dekomponerer veldig voldsomt å frigjøre store mengder varme, noe som forårsaker en stor eksplosjon. Den kjemiske reaksjonen er:
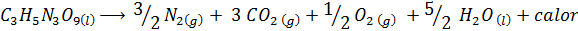
Denne reaksjonen har en ΔH = -368 kcal⁄mol, Så det er en eksotermisk reaksjon.
Spontan forbrenning av hvitt fosfor
Fosforelementet (P) kan bli funnet som rød fosfor eller hvit fosfor. Hvit fosfor. Reaksjonen er:
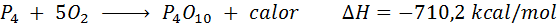
Cellulær pust
Cellulær pust er en eksoterm kjemisk reaksjon som består i oksidasjonen av maten vi spiser. Varmen frigjort av denne reaksjonen brukes av celler for å utføre uendelige endotermiske kjemiske reaksjoner som krever at energi skal oppstå.
Fyrverkeri
Fyrverkeri inneholder svart krutt som den viktigste eksplosive komponenten. Krutt er en blanding som inneholder kaliumnitrat, grafitt og svovelkarbon som reagerer med hverandre gjennom en eksoterm reaksjon. Varmen som denne reaksjonen frigjør, genererer det brede spekteret av farger som vi ser i himmelen når fyrverkeri eksploderer.
Den kjemiske termiske puten
Termiske pads brukes som varme komprimeringer for å lindre sportsskader. Disse består av en forseglet pose som inneholder vann og en kjemiker inne i et lite rør. Når røret er ødelagt, blandes kjemikeren med vannet som produserer en eksoterm kjemisk reaksjon som varmer opp puten.
Metallisk natriumreaksjon med vann
Natrium (Na) er et veldig reaktivt alkalisk metall som når du kommer i kontakt med vann reagerer voldsomt og frigjør mye varme og gasshydrogen. Reaksjonen er:
Det kan tjene deg: metoder for separasjon av heterogene blandinger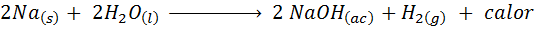
Denne reaksjonen frigjør 1900 kalorier for hvert gram Na som reagerer med vann. Dette betyr at 1 gram natrium ville være nok til å varme opp 3 middels kaffekopper.
Detergent oppløsning
Dette er en reaksjon som alle kan oppleve i hjemmet sitt. Når du tar en håndfull støvvaskemiddel for å vaske klær og våte den med litt vann, vil hånden umiddelbart føles varm. Dette er fordi prosessen med oppløsning av vaskemiddelet i vann er eksotermisk.
Trimita -reaksjonen
Terminita er en blanding av aluminium i form av et veldig fint pulver og et oksid av et annet metall som jern. Etter en gnist er reaksjonen som oppstår:
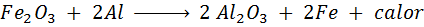
Denne reaksjonen frigjør så mye varme, som er i stand til å smelte jern og brukes mye til å sveise togskinner.
Vannkondensasjon
For alle stoffer, gassfaseforandringer (kondens), flytende til fast (størkning) og fast gass (avsetning), frigjør alltid varme og er derfor eksotermiske prosesser. Når det gjelder vann, frigjør kondensering av bare 18 gram vann cirka 10.000 kalorier, som er nok til å varme opp 15 små kaffekopper.
Referanser
- Chang, R. og Goldsby, k. (2014). Kjemi. 11. utg. New York: McGraw-Hill Education.
- Eksotermisk reaksjon (2020, 19. desember). I Wikipedia. Tatt fra.Wikipedia.org
- Holmes, w. S. (1963). Forbrenningsvarme av fosfor og dannelse av dannelse av P4O10 og H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. fra en., F. Yo. (2014). Fyrverkeri, raketter og mye kjemi. Kjemisk utdanning. 44-51. Doi: 10.2436/20.2003.02.134
- Termitt reaksjon. University of Minnesota (Department of Chemistry). Hentet fra Chem.Umn.Edu

