Eksotermiske og endotermiske reaksjoner
- 811
- 154
- Marius Aasen
 Forbrenning er et eksempel på eksoterm reaksjon, siden den frigjør varme. For sin del smelter Ice gjennom en endoterm reaksjon, siden den krever termisk energi
Forbrenning er et eksempel på eksoterm reaksjon, siden den frigjør varme. For sin del smelter Ice gjennom en endoterm reaksjon, siden den krever termisk energi De eksotermiske og endotermiske reaksjoner De er forskjellige i det faktum at den første frigjøring av termisk energi, mens sistnevnte absorberer den, i henhold til varmeendringene som oppstår under kjemiske reaksjoner.
Tilsvarende kan andre typer energi være involvert i kjemiske reaksjoner, siden noen ganger under reaksjonen produseres lett energi, lydenergi og til og med strøm.
For å ta hensyn til ikke bare varme, men andre typer energi, er kjemiske reaksjoner klassifisert som eksergonic og Endermanics. En eksergonisk reaksjon frigjør energi når den produseres, mens en endegonic absorberer den.
I dette tilfellet er en eksotermisk reaksjon også en eksergonisk reaksjon, ettersom den frigjør varme. Et av de mest kjente eksemplene er forbrenning. Hver gang et tre stykke blir brent, frigjøres kalori og lys energi.
På den annen side oppstår en av de mest kjente kjemiske reaksjonene i endergiving når man smelter en isbit, siden is absorberer termisk energi i miljøet for å transformere til flytende vann.
En eksoterm reaksjon kan oppstå spontant, selv om du noen ganger må gjøre noe arbeid for å begynne. Imidlertid, for at en endotermisk reaksjon skal oppstå, er det alltid nødvendig for miljøet å gjøre en jobb på systemet.
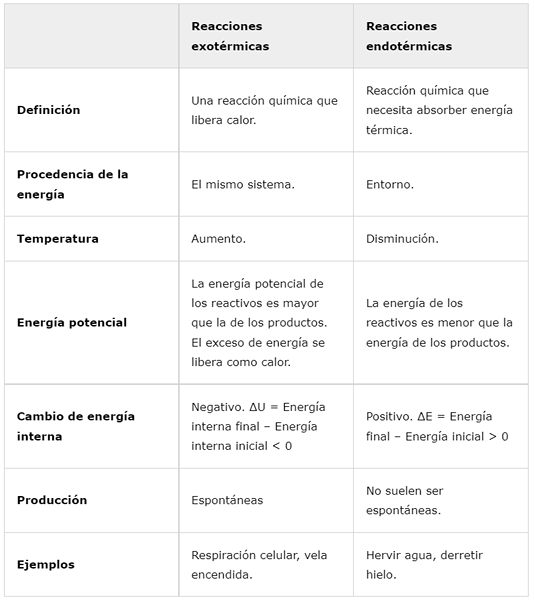
Eksotermiske reaksjoner | Endotermiske reaksjoner | |
Definisjon | En kjemisk reaksjon som frigjør varme. | Kjemisk reaksjon som må absorbere termisk energi. |
Energiens opprinnelse | Det samme systemet. | Rundt. |
Temperatur | Øke. | Avta. |
Potensiell energi | Reagensens potensielle energi er større enn produktene. Overskytende energi frigjøres som varme. | Reagensens energi er mindre enn energien til produktene. |
Intern energiendring | Negativ. ΔU = endelig intern energi - innledende intern energi < 0 | Positivt. ΔE = endelig energi - Innledende energi> 0 |
Produksjon | Spontan | De er vanligvis ikke spontane. |
Eksempler | Cellulær pust, brennende stearinlys. | Kok vann, smelte is. |
Eksotermiske reaksjoner
Definisjon
Type kjemisk reaksjon som frigjør varme når den utføres.
Det kan tjene deg: Cyclohexen: Struktur, egenskaper, syntese og brukEnergiens opprinnelse
Det samme systemet gir energi slik at reaksjonen oppstår.
Temperatur
Etter reaksjonen er det en øke av temperatur.
Potensiell energi
Når en kjemisk reaksjon oppstår mellom reagensene, blir koblinger ødelagt mellom dem og andre dannes for å lage nye molekyler. Men ikke alle koblinger forener atomer og molekyler med samme kraft, derfor er energi til å bryte eller opprette hver lenke forskjellig.
Under hver reaksjon bryter de og skaper forskjellige antall lenker, så energi er annerledes. I en eksoterm reaksjon er reagensens potensielle energi er eldre enn produktene, og siden energien er bevart, frigjøres overskuddet som varme.
Intern energiendring
Intern energi er relatert til systemets evne til å utføre arbeid, og inkluderer potensiell energi og kinetisk energi. Systemets absolutte energi er ikke bestemt, men variasjonen, kalt ΔU.
I henhold til det som ble sagt i forrige seksjon, er endringen av intern energi ΔU negativ.
ΔU = endelig intern energi - Innledende indre energi < 0
Produksjon
De fleste eksotermiske reaksjoner er spontan, det vil si at de finner sted for seg selv, uten behov for å legge til ekstern energi, til reagensene er utmattet.
Eksempler
Normalt er oksidasjonsreaksjoner og de som fører til sammensatt dannelse vanligvis eksotermiske reaksjoner:
1. Oppløs vaskemiddel i vann
Når han løser opp klesstøv i litt kaldt vann, føler han seg varmt når han berører det.
2. Cellulær pust
Hos dyr og planter utføres den cellulære respirasjonsprosessen som en del av karbonsyklusen. Pust bruker glukose og oksygen for å returnere karbondioksid, vann og energi, i henhold til reaksjonen:
Kan tjene deg: titanoksid (IV): Struktur, egenskaper, brukC6H12ENTEN6 + 62 → 6CO2 + H2O + Energy (ATP)
3. Et brennende stearinlys
I tillegg til lys gir et brennende stearinlys av varme og andre stoffer:
Oksygen oksygen → vann + karbondioksid + lys og varme
4. Bombingbillen
Dette insektet forsvarer seg ved å strø en aerosol om rovdyrene. Billen holder væsker og enzymer i separate rom, plassert i magen.
Når den er truet, utviser det væskene mot enzymetsrommet og en kjemisk reaksjon som genererer damp og varme produseres, og fungerer som et avvisende middel for mulige rovdyr.
5. Stål og eddikull
Et metalllignende jern oksyderes sakte når det reagerer med miljøet, men hvis eddik tilsettes litt stålull, observeres det at oksidasjon er mye raskere og samtidig genererer varme.
Endotermiske reaksjoner
Definisjon
Reaksjoner der reagenser trenger å absorbere termisk energi slik at produktene oppnås.
Energiens opprinnelse
Energien som er nødvendig for at reaksjonen skal utføres inntektene fra miljøet.
Temperatur
Den endotermiske reaksjonen innebærer en avta av temperatur.
Potensiell energi
I motsetning til hva som skjer med en eksoterm reaksjon, reagensens energi Det er mindre at energien til produktene.
Intern energiendring
I en endoterm reaksjon er endringen av indre energi ΔE positiv.
ΔE = endelig energi - Innledende energi> 0
Derfor er den endelige energien større enn den første.
Produksjon
Endotermiske reaksjoner krever at arbeidet med systemet gjøres, så de er vanligvis ikke spontan.
Imidlertid er det noen endotermiske reaksjoner, for eksempel smelting av is og fordampning av visse væsker, som er spontan ved romtemperatur.
Det konkluderes da med at temperaturen i miljøet er en avgjørende faktor i spontaniteten til en kjemisk reaksjon.
Det kan tjene deg: Kjemiske indikatorer: Hva er de for, typer, eksemplerEksempler
Mange av reaksjonene som involverer salteroppløsning, og generelt er stoffnedbrytning vanligvis endotermisk. På samme måte er passering av is til flytende vann, og av damp flytende vann, det vil si transformasjonene av staten, også endotermiske reaksjoner.
1. Fotosyntese
Plantene utfører en kjemisk reaksjon i nærvær av sollys, der de omdanner karbondioksid og vann til glukose og oksygen. Klorofyll er nøkkelmolekylet i denne prosessen, hvis kjemiske reaksjon er:
Lys + 6co2 + H2O → c6H12ENTEN6 + 62
Som det kan sees, er det omvendt reaksjon av pust. For å produsere et kilo glukose, er det behov for 15 mega joules med solenergi.
2. Kok vann og kok
En veldig vanlig reaksjon, som krever at energi fortsetter, er kokende vann:
H2O (væske) + energi → h2O (damp)
Mat som normalt krever vann til matlaging, og på samme måte må vannet de inneholder fordampe for å koke dem, noe som innebærer en tilstandsendring.
3. Å smelte isen
Tilsvarende er det vanlig at is smelter ved romtemperatur, hvis dette er større enn 0 ° C:
H2O (solid) + energi → h2O (væske)
Derfor avkjøles drinken når du tilsetter is, siden den absorberer energien som er nødvendig for å endre tilstand fra væsken.
4. Kalde poser
De er vant til å behandle blåmerker og slag. Inneholder vann og en konvolutt med ammoniumklorid. Når du tapper på posen, er konvolutten ødelagt og reaksjonen av ammoniumklorid med vann, som er endotermisk, kjøler posen og lindrer smerte.
5. Ozonproduksjon
Ultraviolett stråling fra solen gjør oksygen til ozon, og slipper varme i prosessen.
32 (gass) + ultrafiolett lys → 23 (gass)
Referanser
- Byju's. Forskjell mellom edotermiske og eksotermiske reaksjoner. Gjenopprettet fra Byjus.com
- Chang, R. (2013). Kjemi. 11va. Utgave. McGraw Hill Education.
- Grelane. Eksotermiske reaksjoner på varme ting. Gjenopprettet fra: Grelane.com.
- Hein, m. (2014). Grunnlag for college kjemi. Wiley.
- Helmestine, a. Forstå endotermiske og eksotermiske reaksjoner. Gjenopprettet fra: Thoughtco.com

