Grunnleggende salterformel, egenskaper, nomenklatur, eksempler

- 729
- 203
- Mathias Aas
De Grunnleggende salter De er alle de som oppløses i vann genererer løsninger med pH -verdier større enn 7. Dette forklares med OH -ionedannelse-, som kommer direkte fra oppløsningsprosessen eller hydrolysebalansen der Anion deltar.
Grunnleggende salter inneholder anion oh- I deres faste stoffer. For eksempel regnes alkaliske hydroksider, som natrium og kalium, NaOH og KOH, som medlemmer av disse saltene; Selv om de er ekstremt kaustiske, er det grunnen til at de fortjener kirkesamfunn av hydroksider i stedet for å bli kalt salter.
 Natriumhydroksyd er et eksempel på grunnleggende salt
Natriumhydroksyd er et eksempel på grunnleggende salt Andre grunnleggende salter har i stedet anioner som karbonat, CO32-. Karbonat stammer fra karbonsyre, h2Co3, En svak syre. Derfor er karbonatsalter, som kalsiumkarbonat brukt i antacida, klassifisert som grunnleggende salter. Den samme resonnementet gjelder natriumbikarbonat, Nahco3, Og for alle andre bikarbonatsalter.
Grunnleggende salter er viktige fordi flere av dem hjelper til med å nøytralisere matsurhet. De kan også brukes til å fremstille dempeløsninger til alkalisk pH.
[TOC]
Definisjoner
Grunnleggende salter har to definisjoner som kompletterer hverandre: De inneholder OH -anioner- I deres faste stoffer, eller generere de samme hydroksillianionene når krystallene deres oppløses i vann.
Uansett definisjon som er valgt, vil pH i de vandige oppløsningene være større enn 7, og derfor vil de være alkaliske eller grunnleggende.
Generell formel av grunnleggende salter
Avklart hva som forstås med grunnleggende salt, dens formel, selv om den ikke er strengt generell, er som følger:
Mn(ÅH)WXov
Hvor m er metallisk eller ammoniumkation, åh hydroksilene og xo anionen avledet fra en svak eller sterk syre. Abonnementene n, W og v Hvor mange M, OH og XO utgjør henholdsvis grunnsaltet, så vel som deres proporsjoner.
Noter det v Det kan være lik null, noe som betyr at vi har et alkalisk eller alkalinoterreo hydroksid. Dette er hva som skjer med Naoh og Koh. like måte, W Det kan være null, noe som betyr at det ikke er noen ioner oh-. For eksempel Caco3 Det har ikke OH-, Og likevel forblir det et grunnleggende salt.
Kan tjene deg: Kalsiumsulfid (CAS): Struktur, egenskaper, innhenting, brukFra ovenstående er det konkludert med at den generelle formelen for grunnleggende salter er mn(ÅH)WXov, Men ikke alle salter overholder dette. Derfor er en viktigere faktor å ta hensyn til XO -anionens natur. Dermed vil det bli kjent når et salt er grunnleggende, uavhengig av om det har ioner OH eller ikke- I sine formler.
Grunnleggende salteregenskaper
Grunnleggende salter oppløses i vann etter følgende ligning:
Mn(ÅH)WXov(S) → nM+(AC) + WÅh-(AC) + vXo-(AC)
Merk at når den løser ut slipper Oh -ioner- i vann. Dette påvirker pH i løsningen, og blir alkalisk med en verdi større enn 7. For eksempel løses grunnleggende kalsiumnitrat i vannet i henhold til hvordan det følger:
CA (OH) Nei3(S) → CA2+(AC) + OH-(ac) + nei3-(AC)
Verdiene til n, W og v De er lik 1 for dette saltet.
På den annen side er de grunnleggende saltene som ikke har OH-, Men en anion avledet fra en svak syre hydrolyseres i vannet:
Tyv3(S) → CA2+(AC) + CO32-(AC)
Co32-(AC) + H2Eller (l) ⇌ HCO3-(AC) + OH-(AC)
Merk at produktet av denne hydrolysen er en OH -anion-. Derfra ligger alkaliniteten til disse basene. Imidlertid, og som forventet, er de mindre grunnleggende enn de som allerede har ionene OH- til stede i krystaller. For eksempel er NaOH ekstremt grunnleggende:
NaOH (S) → Na+(AC) + OH-(AC)
Vel, slipp OH -ioner- direkte så snart vannet berører; Eller verre, berører knapt hudfuktighet.
Kan tjene deg: karbokasjon: dannelse, egenskaper, typer, stabilitetAndre fysiske eller kjemiske egenskaper til basiske salter skiller seg ikke for mye fra andre nøytrale eller syresalter.
Nomenklatur
Nomenklaturen av grunnleggende salter avhenger av anionens natur: hvis den er monoatomisk, eller hvis det er en oksoanion. Imidlertid vil denne delen fokusere spesielt på grunnleggende salter med OH -anioner-. De som ikke har dem, har mye enklere nomenklinger å huske eller resonnere.
Med monoatomiske anioner
Monoatomiske anioner er ikke representert som XO, men som x. De stammer fra et Hx -hydrasseid, for eksempel fluorsyre, HF eller saltsyre, HCl, og så videre.
I disse tilfellene blir de systematisk navngitt på to måter:
(Tallprefiks unntatt apen) Hydroxi + anionnavn som slutter med suffikset -uro + navn på metallet med dets valens i parenteser (hvis det har mer enn en)
For eksempel kalles Salt Ni (OH) CL nikkelhydroksyklorid (II).
Anionnavn med terminering -Uro + -(Numeral Prefix unntatt ape) Hydroksyd + metallnavn og dets valens i parenteser
For eksempel kan salt Ni (OH) CL også kalles nikkelklorid-hydroksyd (II).
Vi har også den tradisjonelle nomenklaturen, noen ganger blandet med det systematiske:
Anionnavn etterfulgt av (Numeral Prefix unntatt apen) Basic og navnet på metall.
For eksempel kalles Ni (OH) CL nikkel basisk klorid, eller grunnleggende nikkelklorid (II).
Med oksoanjoner
Den systematiske nomenklaturen for grunnleggende salter som har oksoanjoner er litt mer komplisert. Imidlertid er den enkleste versjonen bygget som følger:
(Numeral Prefix) Hydroksyd- (anionnavn) + av + metallnavn og dets Valencia i parenteser
For eksempel tro (å) nei3 kalles: hydroksydjerns nitrat (II).
Den har også den tradisjonelle nomenklaturen:
Basic Nion + (Numeral Prefix) Navn + Metal Name Ending In -OSO eller -ICO
Kan tjene deg: oksygen: egenskaper, struktur, risiko, brukDermed tro (å) nei3 Det kalles: jernholdig grunnleggende nitrat, eller grunnleggende jernnitrat (II).
Opplæring
Grunnleggende salter er et produkt av syre-base-nøytraliseringer, spesielt mellom en hydrati eller en oksoacid med et overskudd av en base eller hydroksyd:
Base (overflødig) + syre → Basisk salt eller alkalisk + vann
For eksempel CA (OH) Nei3 Det dannes ved nøytralisering av salpetersyre med et overskudd av kalsiumhydroksyd:
CA (OH)2(Overskudd) + HNO3 → CA (OH) Nei3 + H2ENTEN
En annen dannelse av trening vil være som følger:
Tro (å)3(Overskudd) + H2SW4 → Fe (OH) Så4 + 2H2ENTEN
Dette saltet kalles: basisk jernsulfat, basisk jernsulfat (III) eller jernhydroksyd-sulfat (III).
Eksempler på grunnleggende salter
 Antacida, for eksempel kalsiumkarbonat, CACO3, er eksempler på grunnleggende salter. Kilde: Pixabay.
Antacida, for eksempel kalsiumkarbonat, CACO3, er eksempler på grunnleggende salter. Kilde: Pixabay. Til slutt vil noen andre eksempler på grunnleggende salter bli oppført sammen med deres enklere navn:
-Nach3COO: natriumacetat
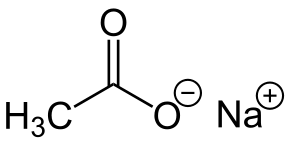 Natriumacetat
Natriumacetat -Na2S: natriumsulfid
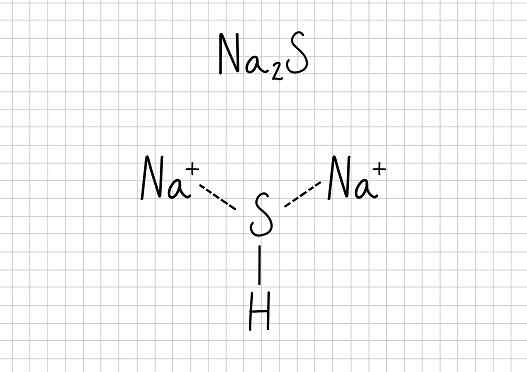 Natriumsulfid
Natriumsulfid -KCN: Kaliumcyanid
-MGCO3: magnesiumkarbonat
-Tro (å) så3: Grunnleggende jernsulfitt (III)
-Tro (OH) (C6H5Coo)2: Basic Iron Benzoate (III)
-AUCL (OH)2: Gold Dibasic Chloride (III)
-Cuclo3(Å): Grunnleggende kobberklorat (ii)
-På (oh) så4: Grunnleggende aluminiumsulfat
-PB (OH)2Co3: Dibasic bly karbonat (IV)
Problemet med grunnleggende salter er at ikke alle av dem kan tilberedes, fordi et overskudd av base eller hydroksid ikke er nok til å krystallisere dem uten å ty til andre prosesser. Det er tilfelle av PB (OH)2Co3. Imidlertid eksisterer dette karbonatet som en hvit bly (ii) pigment, hvis formel er 2pbco3· PB (OH)2 eller pb3(ÅH)2(Co3)2.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Alkali salt. Hentet fra: i.Wikipedia.org
- Wu c., Dowell c. & Hooper n. (1. juli 2014). Syre-base egenskaper til salter. Gjenopprettet fra: Chem.Librettexts.org
- Nicola McDougal. (2020). Syre og grunnleggende saltløsninger: Forklaring og eksempel. Studere. Gjenopprettet fra: Studie.com
- Problem og kjemiske øvelser. (s.F.). Grunnleggende salter. Gjenopprettet fra: Acorral.er

