Diazoniumsalter

- 5042
- 849
- Markus Fredriksen
Vi forklarer hva diazoniumsalter er, hvordan deres egenskaper og applikasjoner dannes
Hva er diazoniumsalter?
De Diazoniumsalter De er organiske forbindelser der det er ioniske interaksjoner mellom Azo-gruppen (-N2+) Og en anion x- (CL-, F-, Ch3COO-, etc.). Den generelle kjemiske formelen er RN2+X-, og i dette kan sidekjeden R være en alifatisk gruppe eller en arylgruppe; det vil si en aromatisk ring.
I det nedre bildet er strukturen til arenodiazoniumionet representert. De blå kulene tilsvarer Azo -gruppen, mens svart og hvitt utgjør den aromatiske ringen til fenylgruppen. AZ+≡N).

Imidlertid er det resonansstrukturer som delokaliserer denne positive belastningen, for eksempel i atomet i nabolandet nitrogen: -n = n+. Dette har sin opprinnelse når et par elektroner som danner lenke rettes til nitrogenatomet til venstre.
På samme måte er denne positive belastningen i stand til å demosiere gjennom PI -systemet til den aromatiske ringen. Som en konsekvens er aromatiske diazoniumsalter mer stabile enn alifatiske, siden den positive belastningen ikke kan demokere langs en karbonkjede (CH3, Ch2Ch3, etc.).
Opplæring
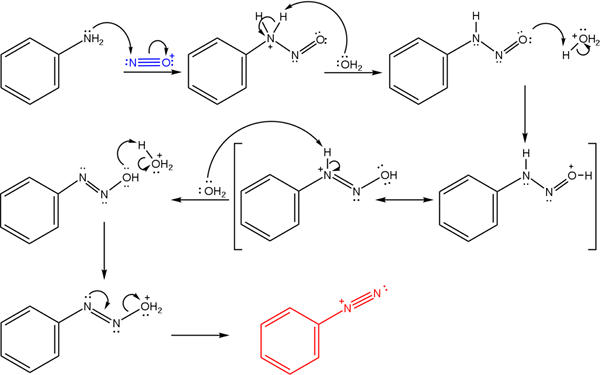
Disse saltene stammer fra reaksjonen av en primær amina med en syreblanding av natriumnitritt (nano2).
Sekundære aminer (r2NH) og tertiær (r3N) Andre nitrogenprodukter som n-nitrosoamin (som er gulaktige oljer), aminsalter (r3Hn+X-) og n-nitrosoniumforbindelser.
Det overordnede bildet illustrerer mekanismen som dannelsen av diazoniumsalter, eller også kjent som diazotiseringsreaksjon, styres.
Kan tjene deg: krom (CR)Reaksjonen starter fra fenylamin (AR-NH2), som utfører et nukleofilt angrep på nitrooniumkationatom (nei+). Denne kationen produseres av Nano -blandingen2/Hx, der x vanligvis er cl; det vil si HCl.
Dannelsen av nitrooniumkation frigjør vann i midten, som snapper en positivt lastet nitrogenproton.
Da, det samme vannmolekylet (eller andre syrearter som er forskjellige fra H3ENTEN+) gi et proton til oksygen, og demokkerer den positive belastningen i det mindre elektronegative nitrogenatom).
Nå er vannet igjen ubeskyttet til nitrogen, og produserer deretter diazohydroksydmolekylet (sekvensens antepenultimate).
Ettersom mediet er surt, lider diazohydroksid dehydrering av OH -gruppen; For å motvirke elektronisk ledig stilling, er det frie momentet for trippelkoblingen til Azo -gruppen.
På denne måten, på slutten av mekanismen, forblir Bencenodiazoniumklorid i løsning (C6H5N2+Cl-).
Egenskaper
Generelt er diazoniumsalter fargeløse og krystallinske, oppløselige og stabile ved lave temperaturer (mindre enn 5 ° C).
Noen av disse saltene er så følsomme for mekanisk innvirkning, at enhver fysisk manipulasjon kan detonere dem. Til slutt reagerer de med vann for å danne fenoler.
Forskyvningsreaksjoner
Diazoniumsalter er potensielle molekylære nitrogen, hvis dannelse er fellesnevneren for forskyvningsreaksjoner. I disse fortrenger en art X den ustabile Azo -gruppen, som rømmer som n2(g).
Sandmeyer -reaksjon
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Gatterman -reaksjon
RNA2+ + Cux => arx + n2 + Cu+
I motsetning til Sandmeyers reaksjon, har Gattermans reaksjon metallkobber i stedet for halogenet; det vil si at Cux genereres In situ.
Schiemann -reaksjon
[RNA2+] Bf4- => Arf + bf3 + N2
Kan tjene deg: ketoner: typer, egenskaper, nomenklatur, bruk, eksemplerSchiemanns reaksjon er preget av den termiske nedbrytningen av Benzezonium fluoroborat.
Gomberg Bachmann -reaksjon
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + HCl
Andre forskyvninger
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Po2 + H2O => c6H6 + N2 + H3Po3 + HCl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Stemple2 => Arno2 + N2 + Cu+
Redoksreaksjoner
Diazoniumsalter kan reduseres til arilhydraziner ved bruk av en blanding av CNCL2/HCl:
RNA2+ => Arnhnh2
De kan også reduseres til arilaminer i sterkere reduksjoner med Zn/HCl:
RNA2+ => Rnah2 + NH4Cl
Fotokjemisk nedbrytning
[RNA2+] X- => Arx + n2
Diazoniumsalter er følsomme for nedbrytning ved forekomst av ultrafiolett stråling, eller ved veldig nære bølgelengder.
AZO -koblingsreaksjoner
RNA2+ + AR'H → RNA2Ar ' + h+
Disse reaksjonene er kanskje de mest nyttige og allsidige diazoniumsaltene. Disse saltene er svake elektrofiler (ringen flytter den positive belastningen på Azo -gruppen). For å reagere med aromatiske forbindelser, må de lades negativt, og forårsaker azosforbindelser negativt.
Reaksjonen passerer med effektiv ytelse mellom en pH på 5 og 7. I syre pH er koblingen lavere fordi azo -gruppen protoner, noe som gjør angrepet av den negative ringen umulig.
Også i basisk pH (større enn 10) reagerer diazoniumsalt med OH- Å produsere diazohydroxide, som er relativt inert.
Strukturer av denne typen organiske forbindelser har et veldig stabilt konjugert PI -system, hvis elektroner absorberer og avgir stråling i det synlige spekteret.
Følgelig er azoforbindelser preget av å være fargerike. På grunn av denne egenskapen har de også blitt kalt azoiske farger.
Kan tjene deg: molaritet: konsentrasjon, enheter, beregning, øvelser
Det overordnede bildet illustrerer koblingsbegrepet med oransje av metyl som et eksempel. Midt i strukturen kan azokonsernet observeres som kontakten til de to aromatiske ringene.
Hvilken av de to ringene var elektrofi i begynnelsen av koblingen? Den til høyre, fordi sulfonatgruppen (-so3) Fjern elektronisk ringetetthet, og gjør den enda mer elektrofil.
applikasjoner

En av de mest kommersielle bruksområdene er produksjon av fargestoffer og pigmenter, og dekker også tekstilindustrien i stoffbaner. Disse azoiske forbindelsene er forankret til spesifikke molekylære steder i polymeren, døende av farger.
På grunn av den fotolitiske nedbrytningen, brukes den (mindre enn før) i reproduksjon av dokumenter. Som? Papirområdene dekket av en spesiell plast fjernes, og deretter blir en grunnleggende fenolløsning påført, fargelegging av bokstavene eller designblå.
I organisk syntese brukes de som utgangspunkt for mange aromatiske derivater.
Endelig har de applikasjoner innen smarte materialer. I disse er en overflate (gull, for eksempel) koblet sammen, slik at den kan gi en kjemisk respons på ytre fysiske stimuli.

