Haloid salgsegenskaper, nomenklatur, hvordan dannes de, eksempler

- 3721
- 842
- Jonathan Moe
De Haloid salter De er binære forbindelser dannet av et metall og et ikke -metall, uten noe annet element. Disse saltene dannes ved nøytraliseringsreaksjonen mellom en hydrati -syre med en base. For eksempel: reaksjonen mellom saltsyre (HCl) med natriumhydroksyd (NaOH) for å danne natriumklorid (NaCl).
Haloidale salter dannes også ved reaksjonen av en hydrati med et metall. For eksempel: magnesiumreaksjonen med saltsyre for å danne magnesiumklorid (Mgcl2). Som sett er klorider de mest representative haloidsaltene. De er imidlertid ikke de eneste.
 Halita, natriumklorid i sin naturlige tilstand, er hovedeksemplet på et haloid salt. Kilde: http: // gl.Wikipedia.org/w/indeks.PHP?Tittel = Bruker: Shinichi / Public Domain
Halita, natriumklorid i sin naturlige tilstand, er hovedeksemplet på et haloid salt. Kilde: http: // gl.Wikipedia.org/w/indeks.PHP?Tittel = Bruker: Shinichi / Public Domain Haloid salter, i henhold til noen definisjoner, forstår forbindelsene de inneholder i halogenstrukturen; Det vil si: fluor, klor, brom og jod, så de anses som synonyme med halogenider eller halogenuros.
På samme måte er det innenfor haloidsaltene inkludert av noen forfattere, forbindelser dannet av forening av et metall med et element som bruker dets negative valens, inkludert: karbider, nitrider, fosfuros, sulfider, selenuros, arseniuros, etc. Disse teller også som haloidsalter når de består av to elementer bare.
[TOC]
Haloid salgsegenskaper
Haloid salter er en gruppe forbindelser hvis egenskaper er vanskelige å etablere.
Sterke ioniske koblinger
Generelt består de av faste stoffer med sterke ioniske bindinger mellom ioner av to elementer: m+X-, hvor m+ tilsvarer den metalliske kationen, og x- Anionen avledet fra ikke -metall.
Høye smeltepunkter, kokende og sublimering
De har vanligvis veldig høye fusjons-, kokende og sublimeringspunkter, på grunn av kraften i dens krystallinske struktur.
Det kan tjene deg: DAPI (4 ', 6-Diamidino-2-Fenylindol): Kjennetegn, foundation, brukElektrisitetsledning
I fast tilstand er de dårlige ledere av strøm, men i vandig løsning når de ioniserer, eller når de smelter sammen, blir gode sjåfører.
Utseende
De er krystallinske faste stoffer som når fragmentert pulverisert kan bli en hvit farge. Imidlertid kan mange haloidsalter ha en annen farge. For eksempel er nikkelklorid grønt, mens jernklorid har en svingende farge mellom grønt og rødt.
Løselighet
Flertallet av Haluros -salter er oppløselige i vann, med unntak av sølv, bly (II) og kvikksølvhalogenider (i).
Lukt
Fordi de ikke er flyktige forbindelser, presenterer ikke haloid salter sterk lukt. På grunn av deres komposisjon kan de også være av sur, salte, bitre eller søte smaker.
Nomenklatur
Haloidsaltene er navngitt ved å plassere navnet på anionen med suffikset Aurochs, etterfulgt av navnet på metallet direkte, forut for konjunksjonen av. I tilfelle metallet har mer enn en valens, plasseres metallet med suffikset bjørn eller ICO, Avhengig av hans Valencia.
Navnet på metallet kan også plasseres uten suffiks og med antall oksidasjon i parenteser.
For eksempel: jernklorid (III), eller jernklorid, FECL3.
Hvordan dannes haloidsalter?
Haloidsalter dannes hovedsakelig av tre reaksjoner: nøytralisering, syreaksjon med et metall og reaksjonen av et metall med et metall eller en ikke -metall som virker med en negativ valens.
Nøytraliseringsreaksjon
Det er reaksjonen på en syre med en base, som produserer salt og et vannmolekyl. For eksempel:
HCl +NaOH → NaCl +H2ENTEN
Dette eksemplet ble nevnt for prinsen.
Reaksjon av en syre med et metall
En sterk syre kan reagere med et metall, med opprinnelse av et salt og frigjøring av hydrogen (h2). For eksempel: saltsyre reagerer med sink (Zn) for å danne sinkklorid (ZnCl2):
Kan tjene deg: Analytisk kjemiZn +HCl → Zncl2 + H2
Kombinasjon av et metall med et metall eller en ikke -metall
Disse haloidsaltene er resultatet av kombinasjonen av et metall med et metall eller en ikke -metall fra halogener. For eksempel: Aluminiumfosfuro kombinerer fosfor med Valencia -3, med aluminium med Valencia +3. Nå skyldes denne "kombinasjonen" spesifikke produksjonsreaksjoner for hvert salt.
Bruk/applikasjoner
Metall halogenuros
Metallhalogenuros brukes i lamper med høy intensitet, for eksempel moderne lamper. De brukes også i drivhus eller regnklima for å utfylle naturlig lys. Sølvhalogenider brukes i filmer og fotografiske papirer.
Kalsiumklorid
 Utseende av kalsiumklorid
Utseende av kalsiumklorid Kalsiumklorid brukes som en kalsiumkilde i avløpsvannbehandling. Den brukes også som en kalsiumkilde gjennom elektrolysen. Det brukes i behandlingen av hjertearytmier og i tilfeller av alvorlig hypokalsemi.
Jernklorid
Jernklorid brukes i rensing av avløpsvann og vannrensing. Det brukes også til å registrere eller velge kobber og gripe inn som en katalysator i prosessen med syntese av vinylklorid.
Klorid og kaliumbromid
Kaliumklorid brukes som gjødsel og i behandlingen av hypokalemia eller hypokalemia. Kaliumbromid ble derimot brukt som antikonvulsiv, og brukes for tiden i legemiddelindustrien og som dressing.
Klorid og natriumsulfid
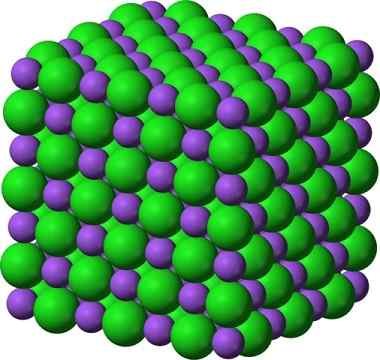
 Den krystallinske strukturen til natriumklorid, NaCl, en typisk ionisk forbindelse. __ lilla kuler representerer natriumkationer, Na +, og __ grønne kuler representerer ancies klorid, cl−.
Den krystallinske strukturen til natriumklorid, NaCl, en typisk ionisk forbindelse. __ lilla kuler representerer natriumkationer, Na +, og __ grønne kuler representerer ancies klorid, cl−. Natriumklorid brukes som en matsmak, i bevaring av kjøtt, som et antiseptisk middel, ved alvorlig hyponatremi, etc. Natriumsulfid brukes i kjernefysiske reaktorer i kraftig vannproduksjon, ved eliminering av skinnhår og i fremstilling av gummi, fargestoffer og malerier.
Kan tjene deg: aluminiumoksyd: struktur, egenskaper, bruksområder, nomenklaturFosfuros og nituros
Aluminium Phosphuro brukes som et bredt bånd halvleder og som et insektmiddel. I mellomtiden brukes Gallium Nitruro som halvleder.
Eksempler på haloid salter
Bortsett fra eksemplene som er nevnt i forrige seksjon, er andre haloidsalter med sine respektive formler og navn:
-NaCl: natriumklorid
-KCL: Kaliumklorid
-Cacl2: Kalsiumklorid
-Mgcl2: Magnesiumklorid
-CSCL: Cesiumklorid
-Bacl2: Bariumklorid
-FECL2: Jernholdig klorid
-FECL3: Jernklorid
-Nicl2: Nikkelklorur
-Cucl: Cuprous klorid
-Cucl2: Kuprisk klorid
-AGCL: Sølvklorid
-Zncl2: Sinkklorid
-CDCL2: Kadmiumklorid
-HGCL2: Merkurisk klorid
-Alcl3: Aluminiumklorid
-NABR: natriumbromid
-KBR: Kaliumbromid
-CSBR: Cesium -bromid
-CDBR: kadmiumbromid
-Mgbr2: Magnesiumbromid
-Srbr2: Strontium Bromide (II)
-Ki: Kalium Yoduro
-Nai: natriumjodid
-CSI: Cesium Yoduro
-Ali3: Aluminiumjodid
-BNP2: Blyjodid (ii)
-NAF: natriumfluorid
-LIF: litiumfluorid
-Caf2: Kalsiumfluorid
-PTF2: Platinumfluorid (II)
-Nas2: Natriumsulfid
-Li4C: Litiumkarbid
-Mg2C: Magnesiumkarbid
-ALP: Aluminium Phosphuro
-Ja3N4: Silisium nitruro
-Tinn: titan nitruro
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Julián Pérez Porto og María Merino. (2016). Definisjon av haloid salter. Definisjon.av. Gjenopprettet fra: Definisjon.av
- James p. Birk. (5. juni 2019). Halide Ins. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Wikipedia. (2020). Halide. Hentet fra: i.Wikipedia.org
- « Peroksydegenskaper, nomenklatur, bruksområder, eksempler
- Termohigometerkarakteristikker, funksjoner, deler, bruker »

