Peroksydegenskaper, nomenklatur, bruksområder, eksempler
- 4504
- 436
- Jonathan Moe
De peroksider De er alle de kjemiske forbindelsene som inneholder Peroxo-gruppen, O-O, enten kovalent knyttet til karbonatomer eller andre funksjonelle grupper, eller i ionisk form som peroksydanion, eller22-. Ovennevnte er representert grafisk i bildet nedenfor. I den skiller O-O-gruppen seg ut med en blå farge.
Det kan være organiske peroksider som diaquilperoxides (r1-O-o-r2), Hydroperoksider (r-o-o-h), peracids (rco-o-o-h) og peéstres (r1Co-o-o-r2). Vi har også uorganiske peroksider, for eksempel metallperoksider (mn+ENTEN22-) og hydrogenperoksyd (H-O-H). Det siste er den mest kjente av alle, og mottar navnet på hydrogenperoksyd.
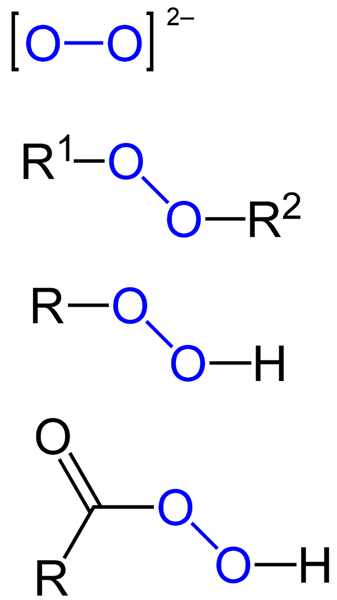 Formler for forskjellige typer peroksider som finnes. Kilde: Jü / Public Domain
Formler for forskjellige typer peroksider som finnes. Kilde: Jü / Public Domain Alle peroksider har felles eiendommen til å være veldig reaktive, oksidere stoffer og i noen tilfeller eksplosivt. Med mindre de ikke er spesifisert ved å syntetisere dem, regnes de som uønskede og farlige urenheter for mange industrielle prosesser og for laboratoriesyntese.
Peroksider generelt er utmerkede oksidasjonsmidler, bleking, bakterikere og polymerisasjoner aktivatorer via frie radikal dannelse. Det er grunnen til at de vanligvis er veldig nyttige reagenser eller tilsetningsstoffer i polymerindustrien, så vel som i matindustrien for å akselerere oksidasjoner og eliminere bakterier.
[TOC]
Peroksydegenskaper
Struktur
Peroksydstrukturer fokuserer rundt O-O-gruppen. Hvert oksygenatom har en SP -hybridisering3, Så lenkene -ikke hviler ikke i samme plan. For eksempel, for hydrogenperoksyd, H-O-H, er vinkelen dannet mellom de to H 115.5. som viser at de fire atomene ikke er på et fly.
Forvrengningene av dette og andre vinkler vil avhenge av identiteten til de andre molekylære fragmentene knyttet til O-O-gruppen.
Det kan tjene deg: Gibbs Gratis energi: enheter, hvordan den beregnes, løste øvelserPå den annen side kan organiske og uorganiske peroksider (unntatt metall) gjenkjennes med det blotte øye hvis O-O-gruppen er detaljert i deres struktur, for eksempel to glass med en "munn". På denne måten identifiseres ethvert peroksyd umiddelbart med et enkelt syn på dens struktur.
Reaktivitet
O-O-koblingen er relativt svak sammenlignet med andre koblinger som C-H eller C-O. Det er grunnen til at det har en tendens til å bryte eller fragmentere å produsere svært reaktive oksygenerte radikaler.
De er på grunn av disse radikaler om at peroksider er klassifisert som reaktive og farlige stoffer, siden de kan skade vev og ethvert organisk materiale generelt.
Oksiderende handling
Peroksider er kraftige oksidasjonsmidler, og søker å få elektroner fra miljøet for å transformere til vann, oksygen eller hydroksider. For eksempel er hydrogenperoksyd et sterkere oksidantmiddel enn det samme kaliumpermanganatet.
Denne oksiderende virkningen brukes til å oppdage dem gjennom deres reaksjon med jernholdig sulfat og kaliumtiocyanat:
Peroksyd +tro2+ + SCN- → Fe (SCN)n(3-n)- (N = 1 til 6).
Komplekset som ble dannet mellom tro3+ og SCN- Det er blodrød, så observasjonen av denne fargen tilsvarer en positiv test for tilstedeværelsen av peroksider i prøven.
Følsomhet
Peroksider er stoffer som er følsomme for høye temperaturer og sollys. Derfor må de lagres på trygge steder og innenfor plast- og ugjennomsiktige beholdere, slik at lys ikke påvirker dem direkte.
Nomenklatur
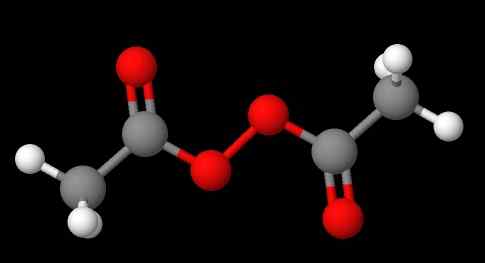
Nomenklaturen til peroksider avhenger av hvilken type de tilhører. Generelt utnevnes mange ved å nevne 'peroksid av' etterfulgt av substituentene r i alfabetisk rekkefølge. For eksempel sammensatt CH3C (O) OOC (O) CH3 (nedre bilde) kalles diacetyl eller acetylperoksyd, da den har en acetylgruppe i hver ende.
Kan tjene deg: natriumsulfat (Na2SO4): Struktur, egenskaper, bruksområder, innhenting Diacetylperoksyd. Kilde: Gabriel Bolívar via Molview.
Diacetylperoksyd. Kilde: Gabriel Bolívar via Molview. Forbindelsen c6H5C (O) OOC (O) C6H5 (Nedre bilde), derimot, kalles det Dibenzoílo eller Benzoílo Peroxide, av de samme grunnene som er angitt i forrige avsnitt.
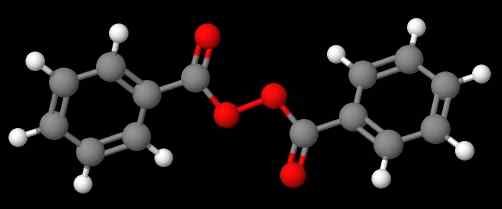 Bensoylperoksid. Kilde: Gabriel Bolívar via Molview.
Bensoylperoksid. Kilde: Gabriel Bolívar via Molview. I mellomtiden, sammensatt C6H5C (O) OOC (O) CH3 kalles acetylbenzolelo peroksyd. Denne gangen nevnes acetylsubstituenten først for å starte med bokstaven 'A'. Et annet eksempel er CH3Ch2Ooc6H5, kalt etylfenylperoksyd.
Tilsvarende fortsett med hydroperoksider. For eksempel Cho3OOH kalles metylhydroperoksyd.
Opplæring
Noen peroksider kan dannes direkte ved eksponering av det aktuelle stoffet med oksygenet i luften, assistert eller ikke med metallkatalysatorer. De kan også danne ved å utsette stoffet for ozon under visse forhold, og utføre ozonolysereaksjonen.
En annen syntetisk rute er å reagere hydrogenperoksyd med et alkylorsulfat:
R2SW4 + H2ENTEN2 → R-O-R +H2SW4
For å syntetisere eller danne diakilperoksider eller til og med sykliske peroksider.
I mellomtiden er flere av metodene for å danne metallperoksider basert på oksygenering av sine respektive metalloksider, slik at de "oksygen" og går fra å være MO (mn+ENTEN2-) Kjærlighet2 (Mn+ENTEN22-).
Peroksider bruker
Polymerisasjoner initiatorer
Peroksider, spesielt organiske peroksider, tilsettes reaksjonsmidlene for syntese av uendelig plast og materialer som polystyren, silikon, epoksy og akrylharpikser, polyvinylklorid, glassfiber, mellom andre.
Dette er fordi de lider av termiske nedbrytninger for å bli oksygenerte frie radikaler, som igjen utløser og katalyserer polymeriseringer. Derfor er de ønskelige i polymerindustrien.
Det kan tjene deg: molar fraksjon: hvordan det beregnes, eksempler, øvelserNoen av peroksydene som brukes som initiativtakere er metylcetona (MEK) peroksyd og acetonperoksyd.
Blekemiddel og desinfeksjonsmidler
Peroksider er blekemidler, brukt til blekingspapir og melmasse. De er også desinfeksjonsmidler, helt effektive, men aggressive når det gjelder utryddelse av bakterier. Det klassiske eksemplet tilsvarer hydrogenperoksyd, ment i utvannede løsninger (3%) for å desinfisere sår.
Oksidasjonsmidler
Peroksider er også oksidasjonsmidler, så de finner mange bruksområder i organisk syntese av veldig oksygenerte stoffer.
Oksygenkilder
Selv om det ikke er blant hovedbrukene, kan peroksider også tjene som oksygenkilder i noen av deres sammenbrudd. Dette er tilfelle igjen av hydrogenperoksydet.
Eksempler på peroksider
Til slutt vil noen eksempler på peroksider bli listet opp, enten det er organiske eller uorganiske, med sine formler og respektive navn:
-H2ENTEN2: Hydrogen eller hydrogenperoksyd
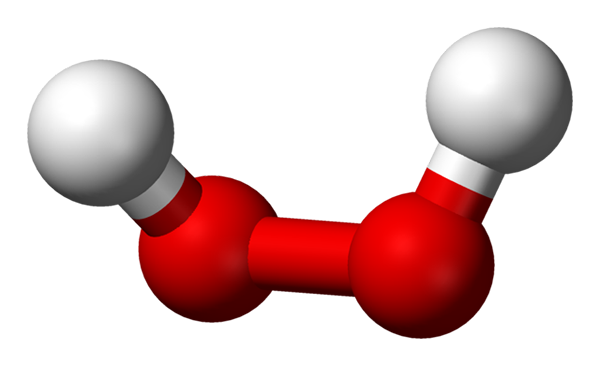 Hydrogenperoksydmolekyl representert med en kuler og barer -modell. Kilde: Benjah-BMM27 via Wikipedia.
Hydrogenperoksydmolekyl representert med en kuler og barer -modell. Kilde: Benjah-BMM27 via Wikipedia. -Na2ENTEN2: natriumperoksyd
-Stråle2: bariumperoksyd
-C6H5C (kap3)2OOH: Cummeno hydroperoksid
-(NH4)2S2ENTEN8: Ammoniumpersulfat
- Ho3Sooso3H: Peroksidisulfurinsyre
-(Ch3)3Cooc (kap3)3: Ditert-butylperoksyd
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Organisk peroksyd. Hentet fra: i.Wikipedia.org
- Elsevier f.V. (2020). Peroksid. Scientedirect. Hentet fra: Scientedirect.com
- Avansert kjemiutvikling. (s.F.). Alkoholer, fenoler og deres stammer:
- Peroksider regel C-218. Gjenopprettet fra: acdlabs.com
- Vol'nov i.Yo., Petrocelli a.W. (1966) Klassifisering og nomenklatur av uorganiske peroksydforbindelser. I: Petrocelli a.W. (Eds) Peroksider, superoksider og ozonider av alkali og alkaliske jordmetaller. Springer, Boston, MA.
- « Typisk Baja California sur for menn og kvinner (beskrivelse)
- Haloid salgsegenskaper, nomenklatur, hvordan dannes de, eksempler »

