Karakteristikker, typer og funksjons selectins
- 3253
- 873
- Oliver Christiansen
De SELECTINAS De er en familie av glykoproteiner som består av polypeptidkjeder, som gjenkjenner spesifikke konformasjoner av sukker (karbohydrater), som ligger på overflaten av andre celler og binder seg til dem. Av denne grunn kalles de også adhesjonsmolekyler.
Disse adhesjonsreseptorene er kjent for sin bevarte struktur. De presenterer tre domener og tre forskjellige glykoproteiner. De kan uttrykkes som overflatemolekyler, i tillegg til å lagres eller fungere som oppløselige molekyler.
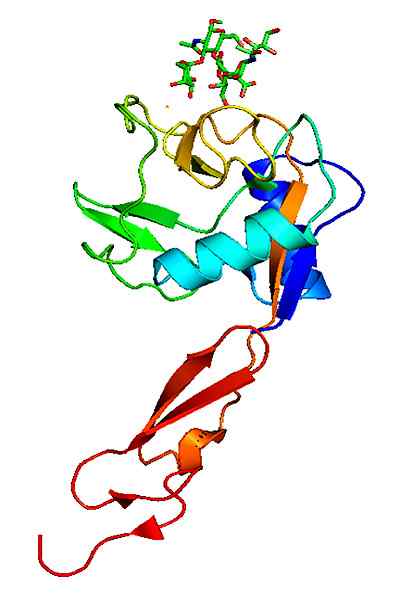
 Molekylær struktur av et p-selectin. Tatt og redigert fra: Neveu, Curtis [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Molekylær struktur av et p-selectin. Tatt og redigert fra: Neveu, Curtis [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. I motsetning til andre adhesjonsmolekyler, virker selectins bare i interaksjonene mellom hvite blodlegemer med det vaskulære endotelet.
[TOC]
Kjennetegn
Selectins er alle proteiner som inneholder kjede oligosakkarider, forent av kovalente bindinger til laterale aminosyrekjeder (glykoproteiner). De er transmembranmolekyler, noe som betyr at de krysser lipid bilay.
De deler egenskaper som er veldig lik CLEC eller Lectinas type C -proteiner. Siden Selectins, som type C -lektin, krever kalsiumioner for å utføre krysset.
Opprinnelsen til ordet "Selectin" refererer til det faktum at disse proteinene selektivt uttrykker i vaskulære systemceller, og også inneholder et lektindomene.
Noen forfattere inkluderer selectins (glykoproteiner) i lektinene fordi de er molekyler som binder seg til sukker. Imidlertid skiller andre forfattere dem under konseptet om at lektina bare gjenkjenner karbohydrater og blir med dem, mens Selectins ikke bare gjenkjenner og blir med i sukker, men også dannes av karbohydrater.
Reguleringen av utvalgene skjer på transkripsjonsnivå, gjennom proteolytisk prosessering, ved cellulær klassifisering og gjennom regulerte uttrykk for glykosil-transferaser.
Selectins har et kort intracellulært domene. Imidlertid har de tre ekstracellulære domener, et domene av typen epidermal vekstfaktor, et domene for lektin type C og repetisjonsenheter, likt de regulatoriske proteiner i komplementet.
Kan tjene deg: Hele -celler: Historie, egenskaper, cellesyklus og brukFolkens
Selectin -familien består av tre forskjellige typer glykoproteiner. Hver av disse er identifisert med et brev som betegner stedet der de først ble identifisert. Neste skal vi se hver av dem.
L-selectin
Det er også kjent som Sell, CD62L, LAM1, Leu8, LNHR, LSEL eller TQ1. Det finnes i leukocytter, derav "l" av selectin. Det er en celleoverflatekomponent. De tre domenene er: et motstykke fra lektinene, en epidermal vekstfaktor og to repetisjonsenheter konsensus.
Den presenterer flere ligander, det vil si generelt små molekyler som danner kompleks med et biomolekyl, i dette tilfellet et protein. De kjente ligandene for L-selectin er følgende.
Glycam1
Kjent som molekylet -1 av cellulær vedheft avhengig av glykosylering, er det en proteoglykansk ligand som uttrykkes i post -kapillær venøs betennelser og lar lymfocytter gå til blodomløpet mot lymfoide vev.
CD34
Det er et fosfografoprotein, påvist i flere grupper av pattedyr, som mann, rotter og mus, blant andre. Det ble først beskrevet i hematopoietiske stamceller. De finnes i en rekke celler, men det er nesten utelukkende relatert til hematopoietics.
Madcam-1
Kjent som AD -harpiks eller celleadhesjonsmolekyl i retning av vaskulær slimhinne (på engelsk, vaskulær slimhinneadresseincelleadhesjonsmolekyl 1). Det er et ekstracellulært protein fra endotelet som er ansvarlig for å bestemme i hvilket vev lymfocyttene vil komme inn, i tillegg til å bære sukker, slik at de blir gjenkjent av L-selectin.
PSGL-1
Det er kjent blant andre synonymer som SELPLG eller CD162, og er et glykoprotein som finnes i endotelceller og i leukocytter. Du kan bli med de to andre typene Selectins. Imidlertid ser det ut til at det gir en bedre tilknytning til p-selectin.
Kan tjene deg: soppceller: Kjennetegn, organeller og funksjonerP-selectin
P-selectin er kjent med andre navn som SELP, CD62, CD62P, GMP140, GRMP eller LECAM3, blant andre. Det ligger på overflaten av endotelcellene, som dekker de indre marginene til blodkar og blodplater.
P-selectin ble identifisert for første gang i blodplater. Det er grunnen til at navnet på proteinet bærer den første "P".
Strukturen til p-selectin består av et domene som er veldig lik type C-lektin ved N EGF-enden; Det vil si et konservert proteindomene på omtrent 30 til 40 aminosyreavfall, med et to-katinjus ß-blad etterfulgt av en løkke til en kortterminal bicatarienær ß-terminal blad.
Den presenterer en tredje doming som ligner på komplementprotein til komplement som kalles, for eksempel Cub -domenet, som er preget av å være et proteindomene som er bevart evolusjonært og ved å presentere rundt 110 aminosyreavfall.
Liganden med større affinitet av p-selectin er PSGL-1, som tidligere beskrevet i L-selectin-ligandene. På den annen side kan dette proteinet også danne komplekser med andre molekyler som sulfaterte polysakkarid kalt fucoidan og heparán sulfat.
E-selectin
Dette Selectin -proteinet er også kjent med følgende navn: Sele, CD62E, Elam, ELAM1, Esel, LECAM2 og andre. Det uttrykkes utelukkende i endotelceller som aktiveres av små proteiner som ikke er i stand til å krysse lipid -dobbeltlaget til cellen, kalt cytokiner.
Strukturen til dette proteinet består av 3 domener (for eksempel resten av utvalgene): et domene som ligner på EGF, 6 enheter av kontrollproteindoduler (også kalt sushi -domener) av gjentatt SCR og et transmembran -domene.
Det kan tjene deg: Megacariocytter: egenskaper, struktur, formasjon, modning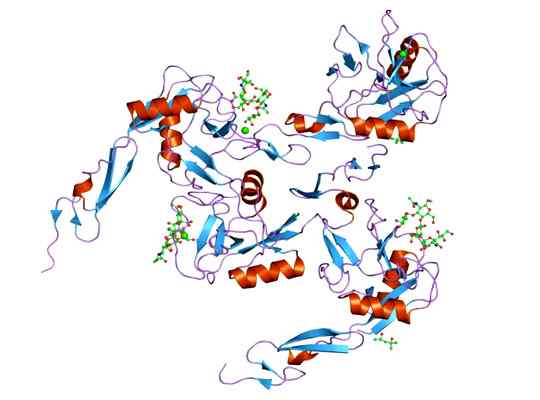 Representasjon av molekylstrukturen til e-selectin-proteinet, hvis domino er EGF. Tatt og redigert fra: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain].
Representasjon av molekylstrukturen til e-selectin-proteinet, hvis domino er EGF. Tatt og redigert fra: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain]. Liganden som danner komplekser med e-selektiv er ganske varierte, men de som skiller seg ut er følgende.
Sialyl-Lewis a
Også kalt SLE A O CA19-9. Det er et tetrasakkarid i sera av kreftpasienter. Det er kjent å delta i cellecellegjenkjenningsprosessen. Det uttrykkes konstitutivt i granulocytter, monocytter og lymfocytter t.
Sialyl-Lewis x
Det er også et tetratasakkarid som Sialyl-Lewis A og har lignende funksjoner. Det kommer til uttrykk i granulocytter og monocytter og kontrollerer uønsket avkjørsel eller lekkasje av disse cellene under betennelse.
PSGL-1
Selv om det tilsynelatende er mer effektivt i P-selectin, vurderer noen forfattere at formen avledet fra human neutrofil, også er ganske effektiv i e-selectin. De anser faktisk at generelt er denne liganden grunnleggende for de tre typene utvalg.
Funksjon
Hovedfunksjonen til utvalgene er å være en del av dannelsesprosessen for hvitt blodlegemer (lymfocytter). De deltar også i immunresponsen, i kroniske og akutte betennelser i forskjellige organer i kroppen som nyrer, hjerte og hud. De handler til og med i de inflammatoriske prosessene med kreftfremkallende metastaser.
Referanser
- SELECTIN. Hentet fra: i.Wikipedia.org.
- L-selectin. Hentet fra: i.Wikipedia.org.
- CA19-9. Hentet fra: i.Wikipedia.org.
- E-selectin. Hentet fra: i.Wikipedia.org.
- X. Zou, v.R. Shinde Patil, n.M. Dagia, l.TIL. Smith, m.J. Wargo, k.TIL. Interliggi, ca.M. Lloyd, d.F. Tees, f. Walcheck, m.B. Lawrence, d.J. Goetz (2005). PSGL-1 oppført fra humane nøytrofiler er en høyeffektiv ligand for Edothelium-Express e-selectin under strømning. American Journal of Physiology. Cellefysiologi.
- K. Lov (2001). Funksjoner av Selectins. Resultater og problemer i celledifferensiering.
- SELECTINAS. Gjenopprettet fra: Wellpath.Uniovi.er.
- J.H. Pérez & C.J. Montoya. Adhesjonsmolekyler. Hentet fra: Encolombia.com.
- TIL.C. Sanguineti & J.M Rodríguez-Tafur (1999). Vedheft og hudmolekyler. Peruansk dermatologi.
- T.F. Tedder, d.TIL. Steeber, a. Chen, s. Engel (1995). Selectins: vaskulære vedheftingsmolekyler. Faseb Journal.
- « Hvite mangrovefunksjoner, habitat, taksonomi, bruker
- Integriner Karakteristikker, struktur og funksjoner »

