SGLT (natrium-glukosetransportproteiner)
- 1626
- 195
- Anders Mathisen
De Natrium-glukosetransportproteiner (Sglt) De er ansvarlige for å utføre aktiv glukosetransport i pattedyrceller mot en konsentrasjonsgradient. Energien som kreves for å gjøre denne transporten mulig er anskaffet fra natriumkotransport i samme retning (Simport).
Plasseringen er begrenset til membranen til cellene som danner epitelvevene som.
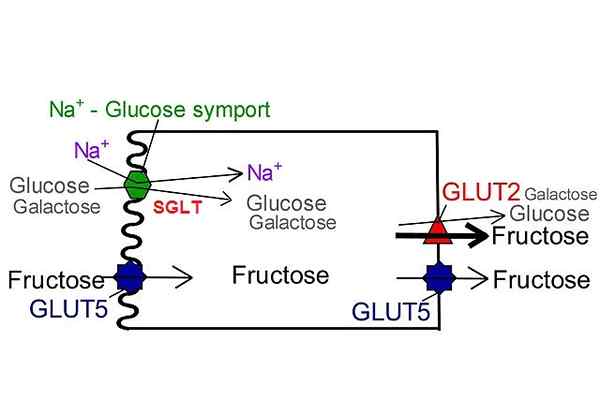
 Sglt glukosetransportører i motsetning til glut. Av NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], modifisert av Wikimedia Commons.
Sglt glukosetransportører i motsetning til glut. Av NUFS, San Jose State University [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], modifisert av Wikimedia Commons. Til dags dato er det bare seks isoformer som tilhører denne transportørens familie: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 og SGLT-6. I dem alle gir den elektrokjemiske strømmen generert ved transport av natriumionet energi og induserer konformasjonsendringen i strukturen til det nødvendige proteinet for å translokere metabolitten på den andre siden av membranen.
Imidlertid skiller alle disse isoformene seg fra hverandre ved å presentere forskjeller i:
- Graden av affinitet de har for glukose,
- Evnen til å utføre glukose, galaktose og aminosyretransport,
- I hvilken grad de blir hemmet av Florizina og
- Vevsstedet.
[TOC]
Molekylære mekanismer for glukosetransport
Glukose er et monosakkarid av seks karbonatomer som brukes av de fleste eksisterende celletyper for å oppnå energi gjennom metabolske oksidasjonsveier.
Gitt dens store størrelse og dens vesentlig hydrofilittiske natur, er den ikke i stand til å krysse cellemembranene ved fri diffusjon. Derfor avhenger cytosolmobilisering av tilstedeværelsen av transportproteiner i disse membranene.
Glukosetransportører så langt studert utfører transport av denne metabolitten ved passive eller aktive transportmekanismer. Passiv transport skiller seg fra aktiv transport der den ikke krever energiforsyning som skal utføres, siden det oppstår til fordel for en konsentrasjonsgradient.
Det kan tjene deg: epidermis of the OnionProteinene som er involvert i den passive glukosetransporten tilhører familien av formidlet formidlet transportører, således kalt av forkortelsen på engelsk av begrepet "glukosetransportører". Mens de som utfører en aktiv transport av den, har blitt kalt SGLT av "natrium-glukosetransportproteiner".
Sistnevnte oppnår den nødvendige frie energien for å utføre transport av glukose mot konsentrasjonsgradienten av natriumionen Cotransport. Minst 6 SGR -isoformer er identifisert og beliggenheten ser ut til å være begrenset til epitelcellemembraner.
SGLT -egenskaper
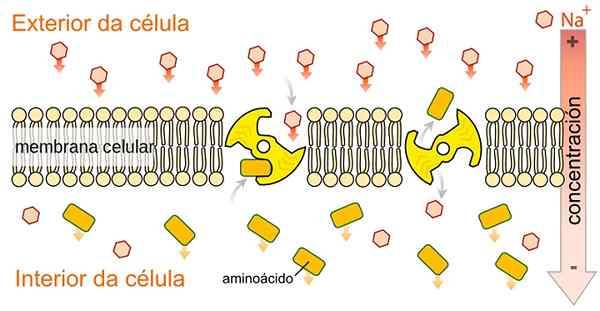 SLGT Simport -trenere er ikke spesifikke for glukose, de er i stand til å transportere et annet utvalg av metabolitter som aminosyrer, galaktose og andre metabolitter, da de bruker energien som frigjøres med natriumionkotransport til fordel for konsentrasjonsgradienten. Av Speciladyofhats [CC0 (https: // creativeCommons.Org/lisenser/by-SA/4.0), fra Wikimedia Commons.
SLGT Simport -trenere er ikke spesifikke for glukose, de er i stand til å transportere et annet utvalg av metabolitter som aminosyrer, galaktose og andre metabolitter, da de bruker energien som frigjøres med natriumionkotransport til fordel for konsentrasjonsgradienten. Av Speciladyofhats [CC0 (https: // creativeCommons.Org/lisenser/by-SA/4.0), fra Wikimedia Commons. Som indikert med navnet, utfører natrium-glukosetransportproteinene simport-typen natrium og glukose eller natrium og galaktosetype cytosol til cellulær cytosol.
Natriumtransport til fordel for en konsentrasjonsgradient er ansvarlig for å generere uunnværlig fri energi for å mobilisere glukose fra en lav konsentrasjonssone til en høy konsentrasjon.
Disse transportørene er en del av en gruppe anti -transport og sympati protein av natrium og hydrogen hvis gener ikke er fylogenetisk relatert.
Plasseringen er begrenset til luminalmembranen til epitelcellene i vev involvert i absorpsjon av næringsstoffer, for eksempel tynn tarmen og den proksimale konturerte tubulen.
Kan tjene deg: Coxiella BurnetiiSGLT -typer
Til dags dato er seks SGLT-transportører (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 og SGLT-6) blitt identifisert. Alle viser forskjeller i preferansen for transport av glukose eller galaktose, affiniteten de presenterer for disse sukkerene og natriumet og ved å kunne hemmet av Florizina.
SGLT1 har evnen til å transportere galaktose i tillegg til glukose med en veldig lik kinetikk, mens SGLT2 bare transporterer glukose.
GSLT -struktur
Lengden på peptidsekvensen til SGLT -proteiner varierer fra 596 til 681 aminosyreavfall. I mellomtiden varierer homologiprosentene mellom sekvensene mellom 50 og 84 % i forhold til SGLT-1, og er den største grad av divergens i sekvensene som tilsvarer det ekstracellulære domene aminoteterminal og terminal karboksyl.
Den generelle strukturen sammenfaller med den fra et multipaso integrert protein, det vil si at den krysser membranen flere ganger gjennom transmembrane domener rik på hydrofobe aminosyrer.
Disse transmembrane-domenene er totalt 14, og hver av dem har en sekundærstruktur α-helix. Segmentene 1, 2, 5, 7 og 9 er romlig organisert i en sentral stilling som gir opphav til dannelsen av hydrofil pore.
Gjennom hydrofile pore transiterer glukose, så vel som noen av de andre metabolittene som transportøren kan ha affinitet. De gjenværende spiralformede fragmentene er organisert parallelt med å gi større strukturell stabilitet til kanalen.
SGLT -funksjoner
SGLT -familiemedlemmer viser ikke unik spesifisitet for glukose. Tvert imot, de er i stand til å aktivt mobilisere gjennom membranen til renale tubule -celler og tarmepitel et bredt utvalg av metabolitter som aminosyrer, ioner, glukose og osmolytter.
Funksjonen til denne typen transportører som har blitt mer studert er reabsorpsjonen av glukosen som er til stede i urinen.
Det kan tjene deg: Sammenlignende embryologi: Hva er det, hvilke studier, historie, teorierDenne reabsorpsjonsprosessen involverer mobilisering av karbohydrat fra nyretubuli gjennom rørformede epitelceller til lumen av peritubulære kapillærer. Å være isoformen av høy kapasitet og affinitet for glukose SGLT-2, som er den viktigste skattebetaleren.
Glukoseabsorpsjonsfunksjonen i tarmkanalen tilskrives SGLT-1, en transportør som til tross for at han har lav kapasitet har en høy affinitet for glukose.
Det tredje medlemmet av denne familien, SGLT3, kommer til uttrykk i membranene til skjelettmuskelceller og nervesystemet, der det ikke ser ut til å fungere som en glukosetransportør, men som en sensor for konsentrasjonen av dette sukkeret i det ekstracellulære mediet.
Funksjonene til SGLT4, SGLT5 og SGLT6 isoformer har ikke vært sikre så langt så langt.
Referanser
- Abramson J, Wright EM. Struktur og funksjon av Na Symporters med inverte repetisjoner. Curr Ace struct Biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Studier på mekanismen for tarmabsorpsjon av sukkerarter. Vii. Fenylglykosidtransport og den. Biochim Biophys Act. 1964; 93: 116-135.
- Charron FM, Blanchard MG, Lapointe JY. Intracellulær hypertonicity er ansvarlig for vannstrømning assosiert med Na_/Glycose Cotransport. Biophys J. 2006; 90: 3546-3554.
- Chen XZ, Coady MJ, Lapointe JY. Rask spenningsklemme Discles til ny komponent av perparoady-state-strømmer fra Na_-Glucose Cotransporter. Biophys J. nitten nittiseks; 71: 2544-2552.
- Dyer J, Wood IS, Palejwala A, Ellis A, Shirazi-Beechey SP. Uttrykk for monosakkaridtransportører i tarmen av diabetiske mennesker. Am J Physiol Gastrointest Liver Physiol. 2002; 282: G241-G248.
- Sátk M, Marks J, Unwin RJ. Antodende vevsplassering og funksjon av SLC5 -familiemedlemmet SGLT3. EXP FYSIOL. 2017; 102 (1): 5-13.
- Turk E, Wright Em. Membrantopologimotiver i SGG Cotransporter -familien. J Memb Biol. 1997; 159: 1-20.
- Turk E, Kim O, Him J, Whitelegge JP, Eskandari S, Lam JT, Kreman M, Zampighi G, Faull KF, Wright EM. Molekylær karakterisering av Vibrio parahaemolyticus VSGLT: En modell for natriumkoblet sukkerkotransportører. J Biol Chem. 2000; 275: 25711-25716.
- Taroni C, Jones S, Thornton JM. Analyse og prediksjon av karbohydratbindingssteder. ENG Protein. 2000; 13: 89-98.
- Wright EM, Loo DD, Hirayama BA. Biologi av human natriumglukosetransportører. Physiol Rev. 2011; 91 (2): 733-794.

