Konsentrert løsning
- 3438
- 836
- Jonathan Moe
Hva er en konsentrert løsning?
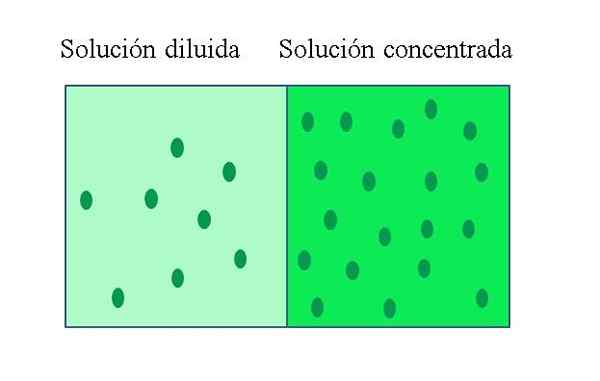
EN konsentrert løsning Det er en som inneholder en stor mengde oppløst stoff i forhold til mengden den kan oppløses. Tvert imot har en utvannet løsning en lav konsentrasjon av oppløst stoff. En fortynnet løsning kan fremstilles fra en konsentrert løsning ved å tilsette løsningsmiddel, eller om mulig, trekke ut løst stoff.
Konseptet kan være relativt, siden det som definerer en konsentrert løsning er de høye verdiene i noen av dens egenskaper; For eksempel har en marengs av Mantecado en høy konsentrasjon av sukker, som er bevist ved sin søte smak.
 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Den solide konsentrasjonen av en konsentrert løsning er nær eller lik den som eksisterer i en mettet løsning. Hovedkarakteristikken ved en mettet løsning er at den ikke kan solubilisere en ekstra mengde løst ved en viss temperatur. Derfor forblir konsentrasjonen av oppløsningen i dets mettede oppløsninger konstant.
Løselighet, av de fleste oppløste stoffer, øker når temperaturen øker. På denne måten kan du solubilisere en ekstra mengde oppløst stoff i en mettet løsning.
Ved å redusere temperaturen økes den oppløste konsentrasjonen av den mettede oppløsningen. Å snakke er denne saken om en overmettet løsning.
Karakteristisk for en konsentrert løsning
Konsentrasjonen av en løsning, det vil si forholdet mellom mengden av et løst stoff og mengden av en løsning eller løsningsmiddel, kan uttrykkes som en prosentandel av løsningen i løsningen (P/V eller P/P).
Det kan også uttrykkes i føflekker fra løsningen per liter løsning (molaritet) og løst ekvivalenter per liter løsning (normalitet).
Det er også vanlig å uttrykke konsentrasjonen av en løsning i mol oppløst per kilo av løsningsmidlet (moleality) eller uttrykke den i mol av et løst stoff i forhold til de totale molene av løsningen (molar fraksjon). I utvannede løsninger er det vanlig å finne konsentrasjonen av en løsning i P.p.m. (deler per million).
Kan tjene deg: viskositet: eksempler, årsaker, enheter, typerUansett hvilken ekspresjonsform for konsentrasjonen av en løsning, har en konsentrert løsning en høy andel av løsningen, i dette tilfellet uttrykt som masse, i forhold til massen eller volumet av løsningen eller løsningsmidlet. Å være denne konsentrasjonen lik løseligheten av oppløsningen i løsningsmidlet eller veldig nær verdien.
Kolligative egenskaper til løsninger
De er et sett med egenskaper til løsninger som er avhengig av antall partikler i løsningen uavhengig av den.
Kolligative egenskaper diskriminerer ikke mellom egenskapene til partiklene, hvis de er natrium, klor, glukose, etc. Det viktige er nummeret ditt.
På grunn av dette faktum var det nødvendig å skape en annen måte å uttrykke konsentrasjonen av en løsning som er relatert til de så kalt kollegative egenskapene. Som svar på dette ble osmolaritets- og osmolalitetsuttrykkene opprettet.
Osmolaritet og osmolalitet
Osmolaritet er relatert til molariteten i løsningen og osmolaliteten med dens molealitet.
Osmolaritetsenhetene er OSM/L -løsning eller MOSM/L -løsning. Mens osmolalitetsenhetene er OSM/kg vann eller MOSM/kg vann.
Osmolaritet = MVG
m = molariteten til løsningen.
v = antall partikler der en forbindelse i vandig løsning dissosierer. For eksempel: For NaCl har V en verdi på 2; For CACL2, V har en verdi på 3 og for glukose, ikke -elektrolytisk forbindelse som ikke dissosierer, v har en verdi på 1.
g = osmotisk koeffisient, korreksjonsfaktor for interaksjon av elektrisk ladede partikler i løsning. Denne korreksjonsfaktoren har en verdi nær 1 for fortynnede løsninger og har en tendens til null når molariteten til den elektrolytiske forbindelsen øker.
Kan tjene deg: Laboratoriørtør: Kjennetegn, funksjoner, brukDe kollegative egenskapene er nevnt nedenfor, som tillater å bestemme hvor mye en løsning er konsentrert.
Damptrykk synker
Når vannet blir oppvarmet, fordamper og dampet dannes et trykk. Som Soluto legges til, reduseres damptrykket.
Derfor har konsentrerte løsninger lavt damptrykk. Forklaringen er at oppløste molekyler beveger seg til vannmolekyler i Agua-Aire-grensesnittet.
Krioskopisk punkt reduseres
Når osmolariteten til en løsning øker temperaturen som den vandige oppløsningen er frossen. Hvis frysetemperaturen på rent vann er 0º C, er frysetemperaturen til en konsentrert vandig oppløsning lavere enn den verdien.
Embullition Point Elevation
I henhold til Raaults lov er høyden av kokepunktet til det rene løsningsmidlet direkte proporsjonal med molariteten til løsningen som stammer ved tilsetning av oppløst. Derfor har konsentrerte løsninger et høyere kokepunkt enn vann.
Osmotisk trykk
Det er to rom med forskjellige konsentrasjoner, atskilt med en membran som lar vannet passere, men som begrenser passering av løst partikler.
Vannet vil strømme fra løsningen som har en lavere konsentrasjon av løst stoff til løsningen som har en større konsentrasjon av løst stoff.
Denne netto strømmen av vann vil forsvinne når vannet samlet seg i kupeen med den høyeste konsentrasjonen genererer et hydrostatisk trykk som motsetter seg strømmen av vann i dette rommet.
Det kan tjene deg: difenylaminVannstrøm ved osmose skjer vanligvis mot konsentrerte løsninger.
Forskjeller mellom konsentrert løsning og fortynnet løsning
-Konsentrerte løsninger har en høy oppløsningsandel i forhold til volumet eller massen av løsning. Fortynnede løsninger har en lav oppløsningsandel i forhold til volumet eller massen av løsningen.
-De har en molaritet, molealitet og normalitet større enn de som presenteres av de utvannede løsningene.
-Frysingspunktet for konsentrerte løsninger er lavere enn for utvannede løsninger; det vil si at de fryser på kaldere temperaturer.
-En konsentrert løsning har mindre damptrykk enn en fortynnet løsning.
-Konsentrerte løsninger har et høyere kokepunkt enn det som er presentert av de utvannede løsningene.
-Kontakt gjennom en semipermeabel membran vil vann strømme fra utvannede løsninger til konsentrerte løsninger.
Eksempler på løsninger
Konsentrert
-Honning er en mettet sukkerløsning. Det er vanlig å observere forekomsten av rekrystallisering av sukker, beviset i tapasene til beholderne som inneholder honning.
-Sjøvann som har en høy konsentrasjon av forskjellige salter.
-Urin fra personer med alvorlig dehydrering.
-Kullsyreholdig vann er en mettet karbondioksidløsning.
Utvannet
-Urinen til en person med overdreven inntak av vann.
-Svette er vanligvis lav osmolaritet.
-Mange medisiner levert i løsning har en lav konsentrasjon.
Referanser
- Wikipedia. Konsentrasjon. Gjenopprettet fra: er.Wikipedia.org
- Fusta l. Konsentrasjon av løsninger: Definisjon og nivåer. Studere. Gjenopprettet fra: Studie.com
- Vandige oppløsninger - molaritet. Gjenopprettet fra: Chem.UCLA.Edu
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.

