Solvasjon
- 1456
- 197
- Anders Mathisen
Hva er solvasjonen?
De Solvasjon Det er den fysiske og kjemiske foreningen mellom løst og løsningsmiddelpartikler i en løsning. Det skiller seg fra begrepet løselighet i det faktum at det ikke er noen termodynamisk balanse mellom et fast stoff og dets oppløste partikler.
Denne foreningen er ansvarlig for de oppløste faste stoffene "forsvinner" med tanke på tilskuerne; Når partiklene i virkeligheten blir veldig små og ender opp "innpakket" av løsningsmiddelmolekyler, noe som gjør dem umulige å observere dem.

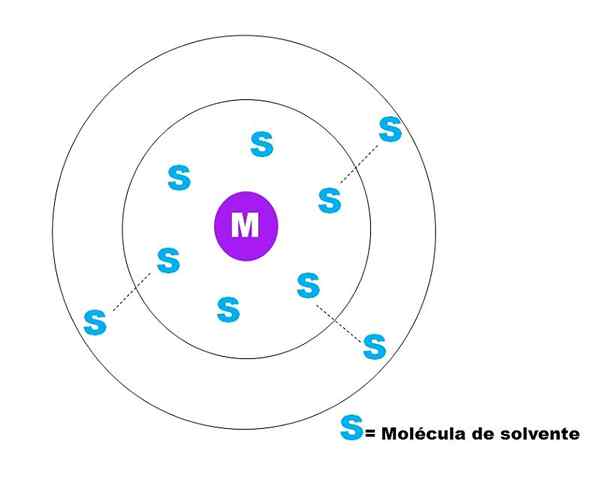
I det øvre bildet er en veldig generell skisse av solvasjonen av en partikkel m representert. M kan være i orden (m+) eller et molekyl; Og S er løsningsmiddelmolekylet, som kan være hvilken som helst forbindelse i flytende tilstand (selv om det også kan være gass).
Merk at M er omgitt av seks s, som utgjør det som er kjent som Primær solvasjonssfære. Andre M -molekyler i en høyere avstand interagerer av van der Waals -styrker med førstnevnte, og danner en sekundær løsningssfære, og så videre til enhver bestilling er tydelig.
Solvasjonsprosess
 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Molekylært, hvordan er solvasjonsprosessen? Det øvre bildet oppsummerer de nødvendige trinnene.
Oppløsningsmiddelmolekylene, blå, er opprinnelig beordret til å samhandle med hverandre (S-S); Og partiklene (ioner eller molekyler) av oppløst, lilla, gjør det samme med sterke eller svake M-M-interaksjoner.
For å få solvasjonen til å oppstå, må både løsningsmiddel og løst stoff utvide (andre svart pil) for å tillate oppløsningsmiddelinteraksjoner (M-S).
Dette innebærer nødvendigvis en reduksjon i oppløsningsmiddel og løsningsmiddelinteraksjoner; reduksjon som krever energi, og derfor er dette første trinnet endotermisk.
Når løst og løsningsmiddel har utvidet seg molekylært, blandes både blanding og utvekslingssteder i verdensrommet. Hver lilla sirkel av det andre bildet kan sammenlignes med det første bildet.
Kan tjene deg: kalsium: egenskaper, struktur, få, brukEn endring i graden av bestilling av partiklene kan beskrives i bildet; bestilt i begynnelsen, og rotete på slutten. Som en konsekvens er det siste trinnet eksotermisk, siden dannelsen av de nye interaksjonene stabiliserer alle partiklene i løsningen.
Energiaspekter
Bak solvasjonsprosessen er det mange energiaspekter som må tas i betraktning. Først: interaksjonene S-S, M-M og M-S.
Når M-S-interaksjonene, det vil si mellom løsningen og løsningsmidlet, er de mye overlegne (sterke og stabile) sammenlignet med de av de enkelte komponentene, er det snakk om en eksoterm løsningsprosess; Og derfor frigjøres energi til miljøet, som kan verifiseres ved å måle temperaturøkningen med et termometer.
Hvis interaksjonene M-M og S-er, tvert imot, er sterkere enn M-S, vil "utvide" trenge mer energi enn den de tjener når solvasjonskulminerer.
Det er da snakk om en endoterm løsningsprosess. Å være denne saken, det er en nedgang i temperaturen, eller hva som er det samme, omgivelsene kjøler.
Det er to grunnleggende faktorer som styrer om et løst oppløses eller ikke oppløses i et løsningsmiddel eller ikke. Den første er endringen av oppløsningsoppløsningen (ΔHDis), Som forklart, og det andre er endringen av entropi (Δs) mellom løst og oppløste oppløst stoff. Generelt er ΔS assosiert med økningen i lidelse også nevnt ovenfor.
Intermolekylære interaksjoner
Det ble nevnt at solvasjonen er et resultat av den fysiske og kjemiske foreningen mellom oppløsningen og løsningsmidlet; Hvordan er imidlertid disse samhandlingene eller fagforeningene?
Hvis løsningen er et ion, m+, De såkalte ion-dipolo-interaksjonene produseres (m+-S); Og hvis det er et molekyl, vil det være dipol-dipolo-interaksjoner eller London-spredningskrefter.
Kan tjene deg: Cyclohexane: Struktur, bruk, konformasjonerNår du snakker om dipolo-dipolo-interaksjoner, sies det at det er et permanent dipolmoment i M og S. Dermed interagerer regionen rik på elektroner Δ- av M med det dårlige området av elektron Δ+ av S. Resultatet av alle disse interaksjonene er dannelsen av flere solvasjonsområder rundt m.
I tillegg er det andre typer interaksjoner: koordinativ. Her danner molekylene av S form koordinasjonslenker (eller dativ) med M, og danner forskjellige geometrier.
En grunnleggende regel for å memorere og forutsi affiniteten mellom løsemidlet og løsningsmidlet er: Lik oppløses like. Derfor oppløses polare stoffer med stor letthet i løsningsmidler like polar; og apolare stoffer, oppløses i apolare løsningsmidler.
Forskjeller mellom solvasjon og hydrering
 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Hvordan er løsningen av hydrering annerledes? De to identiske prosessene, bortsett fra fordi S S, av det første bildet, erstattes av vannet, H-O-H.
I det overlegne bildet kan du se en kation m+ omgitt av seks H -molekyler2ENTEN. Legg merke til at oksygen (røde) atomer er rettet mot positiv belastning, fordi det er det mest elektronegative og derfor har den største negative tettheten Δ-.
Bak den første hydreringsfeltet er andre vannmolekyler gruppert rundt med hydrogenbroer (OH2-Åh2). Dette er interaksjoner med ion-dipolo-type. Imidlertid kan vannmolekyler også danne koordineringsbindinger med det positive senteret, spesielt hvis det er metallisk.
Dermed de berømte Aquocomlejos, M (OH2)n. Som n = 6 på bildet er de seks molekylene orientert rundt M i en oktaedron av koordinering (den interne sfære av hydrering). Avhengig av størrelsen på m+, Størrelsen på belastningen, og dens elektroniske tilgjengelighet, sa sfære kan være mindre eller større.
Kan tjene deg: kromoksid (iii): struktur, nomenklatur, egenskaper, brukVann er kanskje den mest overraskende løsningsmidlet av alle: det løser opp en umåtelig mengde oppløsninger, det er et løsningsmiddel for polar og har en unormalt høy dielektrisk konstant (78.5 k).
Eksempler på løsning
Nedenfor er tre eksempler på oppløsning i vann.
Kalsiumklorid
Når du løser opp kalsiumklorid i vann, frigjøres varmen når CA -kationene er løst2+ og CL -anioner-. Ca2+ Det er omgitt av en rekke vannmolekyler lik eller større enn seks (CA2+-Åh2).
Også CL- Det er omgitt av hydrogenatomer, Δ+ regionen av vannet (CL--H2ENTEN). Det frigjøres varmen kan brukes til ismasses smelting.
Urea
Når det gjelder urea, er det et organisk molekyl med H -struktur2N-co-nh2. Når du løser, h molekyler2O Form hydrogenbroer med de to aminggruppene (-NH2-Åh2) og med karbonylgruppen (C = O- H2ENTEN). Disse interaksjonene er ansvarlige for deres store løselighet i vann.
Også oppløsningen er endotermisk, det vil si at den kjøler vannbeholderen der den tilsettes.
Ammonium Nitrat
Ammoniumnitrat, som urea, er et løst stoff som kjøler oppløsningen etter oppløsningen av ionene. NH4+ Solvata på samme måte som CA2+, Selv om det sannsynligvis fordi det er tetrahedral geometri har mindre H -molekyler2Eller rundt ham; Og nei3- Solvata på samme måte som CL -anioner- (Åh2-ENTEN2NO- H2ENTEN).
Referanser
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). Cengage Learning.
- Belford r. (s.F.). Solvasjonsprosesser. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Guppy Surf. (s.F.). Solvasjonsprosessen. Hentet fra: Surfgupy.com

