Hypotoniske løsningskomponenter, preparat, eksempler
- 3686
- 49
- Magnus Sander Berntsen
EN Hypotonisk løsning Det er en som presenterer en konsentrasjon av mindre oppløst stoff med hensyn til en løsning atskilt eller isolert med en semipermeabel feil. Denne barrieren lar løsningsmidlet Transte, vann i tilfelle av biologiske systemer, men ikke alle løse partikler.
Kroppsvæsker av intracellulære og ekstracellulære virveldyr har en osmolaritet på rundt 300 MOSM/L. Selv om det anses at en hypotonvæske har en osmolaritet mindre enn 280 MOSM/L. Så en løsning av denne osmolariteten er hypoton i forhold til det cellulære mediet.
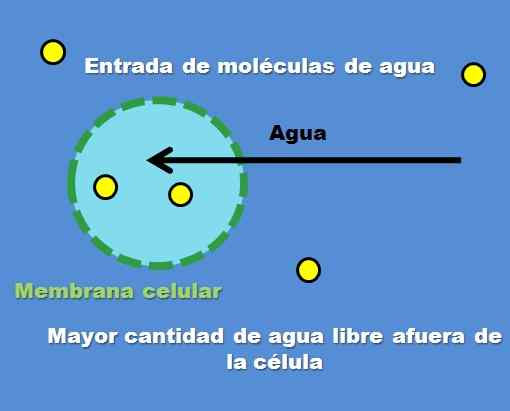
 Interaksjon av en celle med en hypotonløsning. Kilde: Gabriel Bolívar.
Interaksjon av en celle med en hypotonløsning. Kilde: Gabriel Bolívar. Et eksempel på en hypotonoppløsning er 0,45% natriumklorid. Men hvordan oppfører cellen eller avdelingen seg foran denne typen løsning? Det overordnede bildet svarer på dette spørsmålet.
Konsentrasjonen av oppløste partikler (gule punkter) er høyere innenfor den ytre cellen. Å ha mindre løst rundt cellen, det er mer gratis vannmolekyler, så den er representert med en mer intens blå farge sammenlignet med det indre av cellen.
Vann strømmer utover gjennom osmose til nivåkonsentrasjoner. Som et resultat utvides eller vifter ved å absorbere vann som krysser cellemembranen.
[TOC]
Komponenter av hypotoniske løsninger
Hypotoniske løsninger består av et løsningsmiddel som, med mindre annet er angitt, består av vann og oppløsninger oppløst i det som salter, sukker osv., i ren eller blandet form. Men denne løsningen vil ikke ha noen tonicitet hvis det ikke er noen semipermeabel barriere, som blir cellemembranen.
Det kan tjene deg: Kalsiumnitrat (CA (NO3) 2)Det må være få oppløste salter slik at konsentrasjonen er liten, mens "konsentrasjonen" av vannet er høy. Å ha mer fritt vann utenfor cellen, det vil si at den ikke løser eller fuktighetsgivende oppløste partikler, jo større er trykket på cellemembranen og mer har en tendens til å krysse den for å fortynne den intracellulære væsken.
Forberedelse av en hypoton løsning
For utarbeidelse av disse løsningene blir den samme protokollen fulgt som den fulgte for andre løsninger. De aktuelle beregningene av massen av oppløste stoffer blir gjort. Så veies disse, oppløses i vann og tar et flagg som deles til volumet som tilsvarer det.
Den hypotoniske løsningen har en lav osmolaritet, vanligvis mindre enn 280 MOSM/L. Så når vi forbereder en hypotonløsning, må vi beregne osmolariteten din på en slik måte at verdien er mindre enn 280 MOSM/L. Osmolaritet kan beregnes med følgende ligning:
Osmolaritet = m · v · g
Hvor m Det er molariteten til løst stoffet, og v Antall partikler der en forbindelse er dissosiert i løsning. Ikke -elektrolytiske stoffer dissosierer ikke, så verdien av V er lik 1. Dette er tilfellet med glukose og andre sukkerarter.
Samtidig som g er den osmotiske koeffisienten. Dette er en korreksjonsfaktor for interaksjon mellom elektrisk ladede partikler (ioner) i løsning. For utvannede løsninger og ikke -dissosiate stoffer, for eksempel og igjen glukose, tas en verdi av g lik 1. Det sies da at molaritet er identisk med dens osmolaritet.
Eksempel 1
Forbered en natriumkloridløsning (NaCl) ved 0,5 % (P/V) Kontroller om det er en hypotonisk løsning eller ikke eller ikke. NaCl molekylvekt = 58,5 g/mol.
0,5 % A Gram NaCl -løsning per liter bæres:
Kan tjene deg: kalsiumperoksyd (CAO2): egenskaper, risikoer og bruksområderNaCl i g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
Og vi fortsetter med å beregne dens molaritet og deretter bestemme dens osmolaritet:
Molaritet = masse (g/l) ÷ molekylvekt (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 mol/l
NaCl dissosierer i to partikler: Na+ (kation) og cl- (Anion). Så verdien av V = 2. Fordi det er en utvannet 0,5 %NaCl -løsning, kan det også antas at verdien av G (osmotisk koeffisient) er 1. Vi har da:
Osmolaritet (NaCl) = molaritet · V · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 MOSM/L
Dette er en hypotonisk løsning, siden dens osmolaritet er mye lavere enn referansen -osmolariteten for kroppsvæsker som er plasma osmolaritet, hvis verdi er rundt 300 mosk.
Eksempel 2
Forbered en løsning av en blanding av kalsiumklorid (CACL2) ved 0,055 % (P/V) og glukose (C6H12ENTEN6) til 4 % (P/V). Molekylvekter: CACL2 = 111 g/mol og C6H12ENTEN6 = 180 g/mol.
Vi beregner molariteten med konsentrasjonene av de respektive oppløste stoffene ved 0,55 g/l og 40 g/l:
Molaritet (Cacl2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molaritet (ca6H12ENTEN6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
Og på samme måte som vi beregner osmolaritetene, vel vitende om at klikket2 Det dissosierer på tre ioner, to CL- Og en ca2+, og forutsatt at de er veldig utvannede løsninger, så verdien av v Det er 1. Vi har:
Osmolaritet (CaCl2) = 4,95 mm · 3 · 1
= 14.85 MOSM/L
Osmolaritet av (c6H12ENTEN6) = 222 mm · 1 · 1
= 222 MOSM/L
Til slutt blir den totale osmolariteten til løsningen summen av individuelle osmolariteter; det vil si fra NaCl og glukose. Dette er derfor:
Kan tjene deg: ildfaste materialerTotal osmolaritet av løsningen = Cacl osmolaritet2 + osmolaritet c6H12ENTEN6
= 222 MOSM/L + 14.85 MOSM/L
= 236,85 MOSM/L
Løsningen av blandingen av kalsium og glukoseklorid er hypotonisk, siden dens osmolaritet (236,85 MOSM/L) er mye mindre enn plasma -osmolariteten (300 MOSM/L), som blir tatt som en referanse.
Eksempler på hypotoniske løsninger
Natriumkloridløsning
0,45 % natriumkloridløsning administreres intravenøst til pasienter med diabetisk ketose som utvikler dehydrering i interstitielle og intracellulære rom. Vann strømmer fra plasma til disse rommene.
Ringer laktatløsning
Ringer laktatløsning nr. 19 er et annet eksempel på en hypotonisk løsning. Sammensetningen er 0,6 g natriumklorid, 0,03 g kaliumklorid, 0,02 g kalsiumklorid, 0,31 g natriumlaktat og 100 ml destillert vann. Det er en løsning som brukes til pasientrehydrering og er litt hypoton (274 MOSM/L).
Referanser
- Fra Lehr Spilva, til. Og muktans, og. (1999). Guide til farmasøytiske spesialiteter i Venezuela. XXXVª -utgave. Globale utgaver.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2020). Tonicitet. Hentet fra: i.Wikipedia.org
- Union Media LLC. (2020). Isotoniske, hypotoniske og hypertoniske løsninger. Hentet fra: UnionTestPrep.com
- Lodish H, Berk A, Zipursky SL, et al. (2000). Avsnitt 15.8osmose, vannkanaler og regulering av cellevolum. NCBI bokhylle. Gjenopprettet fra: NCBI.NLM.NIH.Gov
- John Brennan. (13. mars 2018). Hvordan beregne isotonisitet. Gjenopprettet fra: Scienting.com

