Umettet løsning
- 3559
- 612
- Thomas Karlsen
 I den umettede løsningen er løsningsmiddelhalvdelen fremdeles i stand til å løse opp mer løst
I den umettede løsningen er løsningsmiddelhalvdelen fremdeles i stand til å løse opp mer løst Hva er en umettet løsning?
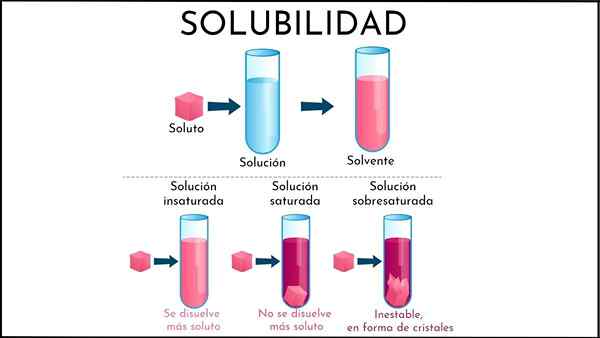
EN umettet løsning Det er all den løsningen der løsningsmiddelmediet fremdeles er i stand til å løse opp mer løst. Dette mediet er generelt flytende, selv om det også kan være gassformig. Når det gjelder oppløst stoff, er det et konglomerat av faste eller gassformede partikler.
Og hva med flytende oppløsninger? I så fall er løsningen homogen så lenge begge væskene er blandbare. Et eksempel på dette er tilsetning av etylalkohol til vannet; De to væskene med molekylene sine, CHO3Ch2Å og h2Eller de er blandbare fordi de danner hydrogenbroer (velg3Ch2ÅH ÅH2).
Imidlertid, hvis diklormetan blandes (velg2Cl2) og vann, disse ville danne en løsning med to faser: den ene vandige og den andre organiske. Dette er fordi Choles of CH2Cl2 og h2Eller samhandle veldig svakt, så noen glir over de andre, noe.
Et minimum dråpe Cho2Cl2 (løst) nok til å mette vannet (løsningsmiddel). Hvis de tvert imot kunne danne en umettet løsning, ville en helt homogen løsning bli sett.
Av denne grunn kan bare faste og gassformige oppløsninger generere umettede løsninger.
Hva er en umettet løsning?
I en umettet løsning interagerer løsningsmiddelmolekyler med effektivitet slik at oppløste molekyler ikke kan danne en annen fase.
Dette betyr at løsningsmiddel-solide interaksjoner overstiger, gitt trykk- og temperaturforholdene, løst-solute interaksjoner.
Når de solute-solute interaksjonene øker, orkestrerer de "dannelsen av en andre fase. For eksempel, hvis løsningsmiddelmediet er en væske, og løst et fast stoff, vil det andre oppløses i den første for å danne en homogen løsning, til en fast fase vises, noe som ikke er noe mer enn det utfelte oppløsningen.
Det kan tjene deg: polymetylmetakrylatDette bunnfallet skyldes det faktum at løstmolekylene klarer å bli gruppert etter deres kjemiske natur, iboende for deres struktur eller lenker. Når dette skjer, sies det at løsningen er mettet med løst stoff.
Derfor består en umettet oppløselig løsning av en flytende fase uten bunnfall. Selv om løsningen er gassformig, må en umettet løsning være fri fra tilstedeværelsen av bobler (som ikke er noe mer enn klynger av brus).
Temperatureffekt
Temperaturen påvirker direkte graden av umettethet av en løsning med hensyn til et løst stoff.
Dette kan hovedsakelig skyldes to grunner:.
Hvis et løsningsmiddelmedium anses som et kompakt rom i hvis hull løstmolekylene er innlosjert, øker temperaturen molekylene vil vibrere å øke størrelsen på disse hullene; på en slik måte at løsningen kan komme seg i andre retninger.
Uoppløselige faste stoffer
Noen oppløste stoffer har imidlertid så sterke interaksjoner, at løsningsmiddelmolekyler knapt er i stand til å skille dem.
Når dette er slik, er en minimal konsentrasjon av nevnte oppløst oppløsning tilstrekkelig til at den kan presipitere, og da er det et uoppløselig fast stoff.
Uoppløselige faste stoffer, ved å danne en annen fast fase som skiller seg fra væskefasen, genererer få umettede løsninger.
For eksempel, hvis 1L av væsken A kan løse opp bare 1g B uten å utfelle, så når du blander 1L av A med 0.5 g B vil generere en umettet løsning.
Det kan tjene deg: hydrokoloidTilsvarende danner en rangering av konsentrasjoner mellom 0 og 1g B også umettede løsninger. Men etter 1G vil B PUSPITATE. Når dette skjer, går løsningen fra å være umettet til mettet fra B.
Hvis en mettet løsning med 1 blir sendt til oppvarming.5g av B, varme vil hjelpe oppløsningen av bunnfallet. Imidlertid, hvis det er mye B utfelt, kan ikke varmen oppløse den.
I så fall vil en økning i temperaturen ganske enkelt fordampe løsningsmidlet eller væsken til.
Eksempler på umettet løsning
Eksemplene på umettede løsninger er mange, siden de er avhengige av løsningsmidlet og oppløst. For eksempel, for den samme væsken A og andre oppløste stoffer C, D, E ... Z, vil løsningene deres være umettet så lenge de ikke utfeller eller danner en boble (hvis de er gassoppløsninger).
-Havet kan bidra med to eksempler. Sjøvann er en massiv bergingsløsning. Hvis du plasserer å koke litt av dette vannet, vil det bemerkes at det er umettet i fravær av utfelt salt. Imidlertid, når vannet fordamper, begynner de oppløste ionene å bli gruppert, og etterlater saltpeter sittende fast i potten.
-Et annet eksempel er oppløsningen av oksygen i havet vann. Molekylet av o2 Frank dybden av havet nok til å puste marin fauna, selv om det er lite løselig.
Av denne grunn er det vanlig å observere oksygenboblene som dukker opp til overflaten; hvorav noen få molekyler klarer å oppløse.
En lignende situasjon oppstår med karbondioksidmolekylet, CO2. I motsetning til O2, Co2 Det er litt mer løselig fordi det reagerer med vann for å danne kullsyre, h2Co3.
Kan tjene deg: materialsystemerForskjell med mettet løsning
Oppsummerer det nyutgitte, hva er forskjellene mellom en umettet og mettet løsning? For det første består det visuelle aspektet: En umettet løsning består av en enkelt fase. Derfor skal det ikke være noen tilstedeværelse av fast fastfra (fast fase) eller boble (brusfase).
Dessuten kan løse konsentrasjoner i en umettet løsning variere til et bunnfall eller boble dannes. Mens de er i mettede, bifasiske løsninger (væske-solid eller væskegase), er konsentrasjonen av oppløst oppløsning konstant.
Fordi? Fordi partiklene (molekyler eller ioner) som utgjør bunnfallet, etablerer en balanse med de som ligger oppløst i løsningsmidlet:
Partikler av bunnfallet oppløste partikler
Boble molekyler oppløste molekyler
Dette scenariet er ikke tenkt i umettede løsninger. Når du prøver å oppløse mer løst i en mettet løsning, beveger balansen seg til venstre; til dannelsen av mer bunnfall eller bobler.
Fordi i umettede løsninger er denne balansen (metning) ennå ikke etablert (metning) kan "lagre" mer solid eller gass.
Rundt en alger i havbunnen er det oppløst oksygen, men når oksygenbobler blir født fra bladene, betyr det at gasmetning oppstår; Ellers ville ikke bobler bli observert.
Referanser
- Generell kjemi. undervisningsmateriell. Lima: Pontifical Catholic University of Peru. Gjenopprettet fra: Korint.PUCP.Edu.PE
- Helmestine, Anne Marie, PH.D. (2018). Umettet løsningsdefinisjon. Gjenopprettet fra: Thoughtco.com
- Tutorvista (s.F.). Umettet løsning. Hentet fra: Kjemi.Tutorvista.com
- Kjemi librettexts (s.F.). Typer metning. Gjenopprettet fra: Chem.Librettexts.org
- Nadine James. (2018). Umettet løsning: Definisjon og eksempel. Gjenopprettet fra: Studie.com

