Ammoniumsulfat
- 2095
- 419
- Marius Aasen
Vi forklarer hva som er ammoniumsulfat, dens kjemiske struktur, fysiske og kjemiske egenskaper og bruker
Hva er ammoniumsulfat?
Han Ammoniumsulfat Det er en ternær og ammoniakk uorganisk salt av svovelsyre. Dens kjemiske formel er (NH4)2SW4. Derfor sier støkiometriske proporsjoner at for hver sulfatanion er det to ammoniumkationer som samhandler med ham. Dette tillater saltnøytralitet ((+1) ∙ 2 + (-2)).
Nomenklaturen skyldes at det er et salt avledet fra H2SW4, Endre "Uric" -suffikset for "ATO". Dermed erstattes de to innledende protonene av NH4+, produkt av reaksjonen med ammoniakk (NH3). Så den kjemiske ligningen for syntesen er: 2 NH3 + H2SW4 => (NH4)2SW4
Ammoniumsulfat er også fremstilt ved reaksjon av ammoniumkarbonat med kalsiumsulfat: (NH4)2Co3 + Sak4 => (NH4)2SW4 + Tyv3, Utfelle karbonatet til calico, som er atskilt fra den gjenværende væsken.
Ammoniumsulfat er lagring av nitrogen og svovel, begge uunnværlige i jordkjemi og gjødsel.
Kjemisk struktur av ammoniumsulfat

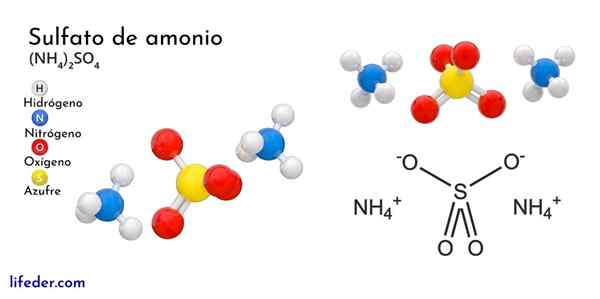
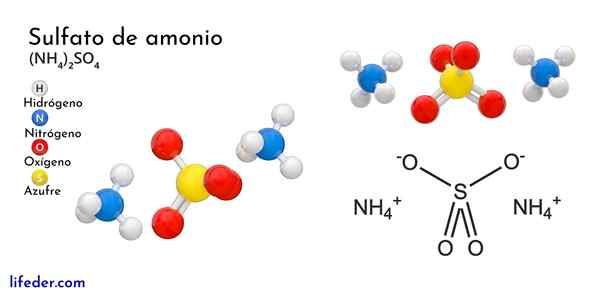
Det overlegne bildet illustrerer molekylære geometrier av NH -ionene4+ Og så42-. De røde kulene tilsvarer oksygenatomer, hvite til hydrogenatomer, blått til nitrogenatom og gult til svovelatom.
Begge ionene kan betraktes som to tetrahedra, og dermed har tre enheter som samhandler for å danne et ortorrombisk krystallinsk arrangement. Sulfatanionen er slik42- Og det er i stand til å donere eller godta fire hydrogenbroer, så vel som NH -kationen4+.
Ammoniumsulfategenskaper
Molekylær vekt
132,134 g/mol.
Det kan tjene deg: Forhold mellom kjemi og teknologi med menneske, helse og miljøFysisk utseende
Hvitt faststoff. Hvite eller brune ortorrhrombiske krystaller, avhengig av urenhetsnivåer.
Lukt
Toalett.
Smeltepunkt
280 ºC. Dette smeltepunktet, under andre ioniske forbindelser, skyldes at det er et salt med monovalente kationer (+1) og med forkledningsioner i størrelsene, noe som får det faste stoffet til å ha lav krystallinsk retikulær energi.
Løselighet
76,4 g/100 g vann ved 25 ° C. Denne affiniteten til vann skyldes den store kapasiteten til molekylene deres for å løse ammoniumionene. På den annen side er det uoppløselig i aceton og alkohol; det vil si i mindre polare løsningsmidler enn vann.
Tetthet
1,77 g/cm3 ved 25 ºC.
Damptrykk
1.871 kPa ved 20 ºC.
Flash Point
26 ºC.
Ph
5,0 - 6,0 (25 ºC. Løsning 1 m). Litt sur pH skyldes NH -hydrolyse4+ I vann, produserer h3ENTEN+ Ved lave konsentrasjoner.
Stabilitet
Stabil i tilstrekkelige miljøforhold. I kontakt med sterke oksidanter kan det sette fyr.
Nedbrytning
Det begynner å dekomponere ved 150 ºC, og frigjør giftig svoveloksyddamp, nitrogenoksyd og ammonium.
Korrosjon
Angriper ikke jern eller aluminium.
Bruk av ammoniumsulfat
I landbruket
- Ammoniumsulfat brukes som gjødsel i alkaliske jordarter. Ammoniumsalt har 21 % nitrogen og 24 % svovel i sin sammensetning. Imidlertid er det forbindelser som gir en mengde nitrogen større enn ammoniumsulfat; Fordelen med sistnevnte er den høye konsentrasjonen av svovel.
- Svovel er viktig i proteinsyntese, siden flere aminosyrer - som cystin, metionin og cystein - har svovel. Av disse grunner fortsetter ammoniumsulfat å være en av de viktigste gjødslene.
- Den brukes i hvete, mais, ris, bomull, potet, hamp og frukttrær avlinger.
- PH i alkaliske jordsmonn ned for deres bidrag i nitrifikasjonsprosessen utført av mikrober. Ammonium brukes (NH4+) å produsere nitrat (nei3-) og slipp h+: 2nh4+ + 4. plass2 => 2no3- + 2H2O + 4H+. Økningen i hydrogenkonsentrasjon reduserer pH i alkalisk jord og tillater mer bruk.
- I tillegg til bruken som gjødsel, fungerer ammoniumsulfat som et adjuvans av oppløselige insektmidler, ugressmidler og soppdrepende midler, som er sprayet på avlinger.
- Sulfat er i stand til å kidnappe ioner som er til stede i jorden og vanningsvann som er nødvendige for livene til visse patogener. Blant ionene som ammoniumsulfatfanger er CA2+, MG2+, tro2+ og tro3+. Denne handlingen forbedrer den mikrobicidale effekten av de nevnte midlene.
Som et analytisk reagens
Ammoniumsulfat fungerer som et utfellingsmiddel i elektrokjemisk analyse, midt i mikrobiologisk kultur og i fremstillingen av ammoniumsalter.
I nedbør og proteinisolasjon
Ammoniumsulfat brukes i isolasjon og proteinrensing, spesielt plasma. Til plasmaet tilsettes en mengde ammoniumsulfat for å ta det til en viss konsentrasjon; Dermed er nedbøren av en proteingruppe forårsaket.
Bunnfallet ved sentrifugering samles og supernatanten tilsettes en ekstra mengde ammoniumsulfat, og til en ny konsentrasjon produseres nedbøren av en annen gruppe protein.
Gjentakelsen av den forrige prosessen tillater sekvensielt å oppnå forskjellige plasmaproteinfraksjoner.
Før de nye teknologiene for molekylærbiologi vises, tillot denne prosedyren isolasjon av plasmaproteiner av stor betydning i medisin, for eksempel: immunoglobuliner, koagulasjonsfaktorer, etc.
I bransjen
Ammoniumsulfat fungerer ved å utsette brannstart i tekstilindustrien. Det brukes som tilsetningsstoff i elektroenchapadobransjen. Det brukes også i produksjonen av hydrogenperoksyd, ammoniumklorid, etc.
Andre bruksområder
- Ammoniumsulfat brukes som et reguleringsmiddel for osmotisk trykk og som et utfellende middel av salter.
- I form av ammoniumsulfat Lauril reduserer det overflatespenningen på vannet, og tillater dermed separasjon av miljøgifter ved en økning i vannhardhet.
- Er et antikorrosivt middel.
- Det brukes som et mattilsetningsstoff som regulerer surhet i meldeig og brød.
- « Oppdrag og personlig visjonskonsept, hvordan gjøre dem, eksempler
- Senere salter hva er, nomenklatur, egenskaper, eksempler »