Natriumsulfat (Na2SO4) struktur, egenskaper, bruk, oppnåelse

- 2778
- 780
- Theodor Anders Hopland
Han natriumsulfat Det er et uorganisk salt hvis kjemiske formel er NA2SW4. Det består av et hvitt fast stoff, til stede i tre former: vannfri, heptohydrat (av liten eksistens) og forfallkroper (som er kjent som Glaubert Salt); Det siste er den mest tallrike formen for natriumsulfat.
Natriumsulfat forfallet, na2SW4· 10H2Eller, det ble oppdaget i 1625 av Glaubert i vannets vann, som utnevnte det saltabilis (mirakuløst salt) på grunn av dens medisinske egenskaper.
 Klokkeglass med en natriumsulfatprøve. Kilde: Walkerma via Wikipedia.
Klokkeglass med en natriumsulfatprøve. Kilde: Walkerma via Wikipedia. Natriumsulfat har mange bruksområder i tekstil- og papirindustrien, så vel som i glassproduksjon. Bruken utvides med termiske applikasjoner, som inkluderer miljøforsyning av varme og avkjøling av bærbare datamaskiner.
Natriumsulfat er en forbindelse med lav toksisitet og dens skadelige handlinger, de er grunnleggende mekaniske og ikke -kjemiske. Av krystallografiske grunner dette saltet, som sin poetassiummotpart, k2SW4, Presenterer rammeverk og polymorfe strukturer.
[TOC]
Struktur
Vannfri salt
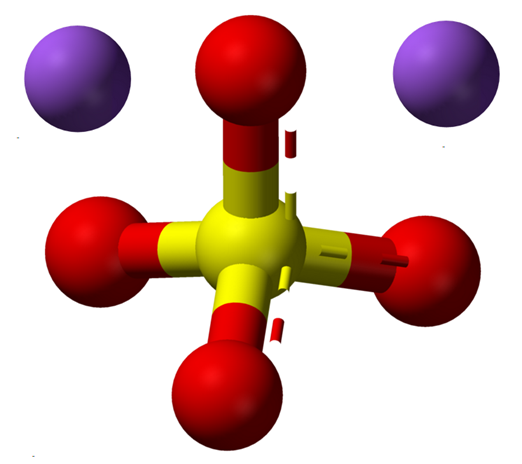 Vannfri natriumsulfateioner. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Vannfri natriumsulfateioner. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Na -formelen2SW4 Indikerer når naionene i saltkrystaller+ Og så42- De er i et forhold på 1: 2; det vil si for hvert to kationer na+ det er en anion så42- samhandle med dem ved elektrostatisk attraksjon (overlegen bilde).
Selvfølgelig gjelder dette NA2SW4 vannfri, uten vannmolekyler koordinert med natrium inne i krystallene.
 Natriumsulfat
Natriumsulfat Til tross for at han er et enkelt utseende, er beskrivelsen strukturelt sammensatt. Deretter en2SW4 Den presenterer polymorfisme, med opptil fem krystallinske faser: I, II, III, IV og V, hvis overgangstemperatur er henholdsvis 180, 200, 228, 235 og 883 ºC.
Selv om det ikke er noen referanser som bekrefter det, NA2SW4Jeg må være den som har en sekskantet krystallinsk struktur, mer tett sammenlignet med Na Ortorrombic2SW4Iii, i hvis krystaller Na+ Tetrahedra form (nao4) og OctaDros (Nao6) koordinering; det vil si at det kan være omgitt av fire eller seks anioner så42-.
Forfalledratada salt
I mellomtiden er den monokliniske krystallinske strukturen til det viktigste hydratet, NA2SW4· 10H2Eller, det er enklere. I den er det praktisk talt vannmolekylene som samhandler eller koordinerer med NA+ I oktaedraen na (h2ENTEN)6+, Med SO42- knapt bidrar med tilstrekkelig stabilitet til glasset til å eksistere i en solid fase.
Det kan tjene deg: First Chemistry RevolutionImidlertid viser smeltepunktet (32,38 ºC) mye lavere enn vannfritt salt (884 ºC) hvordan vannmolekyler og hydrogenbroene deres svekker de ioniske interaksjonene, sterkere, i Na2SW4.
Egenskaper
Navn
-Natriumsulfat (IUPAC)
-Glauber Salt (dehydrat)
-Sala mirakuløs (forfallkroper)
-Disodiumsulfat.
Molmasse
142,04 g/mol (anh¡dro)
322,20 g/mol (dechydrat)
Fysisk utseende
Hvit hygroskopisk krystallinsk faststoff
Lukt
Toalett
Smak
Bitter og saltvann
Tetthet
2.664 g/cm3 (vannfri)
1 464 g/cm3 (Dahydrat)
Legg merke til hvordan vannmolekyler inne i krystallene får dem til å utvide seg og derfor redusere tettheten.
Smeltepunkt
884 ºC (vannfri)
32,38 ºC (dechydrat)
Kokepunkt
1.429 ºC (vannfri)
Vannløselighet
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Alle løselighetsverdier tilsvarer vannfri salt, som er ganske løselig i vann i alle temperaturer.
Løseligheten øker brått mellom 0 ºC og 38,34 ºC, og observerer at i dette temperaturområdet øker løseligheten mer enn 10 ganger. Fra 32,38 ºC er løselighet uavhengig av temperatur imidlertid.
Det hender at ved temperatur 32,8 ºC oppløses den forfallede natriumsulfatet i sitt eget krystallinske vann. Derfor en balanse mellom forfalling salt, anhydra salt og den mettede oppløsningen av natriumsulfat.
Så lenge trefasetilstanden opprettholdes, vil temperaturen forbli konstant, noe som lar temperaturen på termometrene kalibrere.
På den annen side er løseligheten for heptahydratsalt:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ºC)
Merk at ved 20 ° C er heptahydratsaltet tre ganger mer løselig enn vannfri.
Brytningsindeks
1 468 (vannfri)
1,394 (dechydrat)
Stabilitet
Stabil under anbefalte lagringsforhold. Uforenlig med sterke syrer og baser, aluminium og magnesium.
Nedbrytning
Når den blir oppvarmet til nedbrytning, avgir den en giftig røyk av svoveloksyd og natriumoksyd.
Ph
En 5 % vandig løsning har en pH på 7.
Reaktivitet
Natriumsulfat dissosierer i vandig løsning i 2 NA+ Og så42-, som gjør at sulfationet kan kombineres med BA2+ Å presipitere bariumsulfat. Det hjelper praktisk med å bevege bariumionene av vannprøver.
Kan tjene deg: transamineringNatriumsulfat blir natriumsulfid ved reaksjon ved høye temperaturer med kull:
Na2SW4 + 2 c => na2S +2 CO2
Glauberts salt, naso4.10H2O reagerer med kaliumkarbonat for å produsere natriumkarbonat.
applikasjoner
Papirindustri
Natriumsulfat brukes i papirmasseproduksjon. Det brukes til utdyping av Kraft Paper, som ikke inneholder lignin eller underkaster seg blekingsprosessen, grunnen som gir den stor motstand. I tillegg brukes den i pappproduksjon.
Vaskemidler
Det brukes som syntetisk vaskemiddelfyllingsmateriale for bruk hjemme, og legger til vaskemiddel for å redusere overflatespenningen.
Glass
Det brukes i glassproduksjon for å redusere eller eliminere tilstedeværelsen av små luftbobler i smeltet glass. I tillegg eliminerer slaggdannelse under den smeltede glass raffineringsprosessen.
Tekstilindustri
Natriumsulfat brukes som en mordant, siden det letter interaksjonen mellom fargestoffer med stofffibre. Detahydrert natriumsulfat brukes i fargestøvelsen.
I tillegg brukes natriumsulfat som et fargestofffortynningsmiddel og hjelpemidlet for fargestoffer; som direkte fargestoffer, svovelfargestoffer og andre midler som favoriserer bomullsfarging. Det brukes også som et middel som forsinker de direkte fargestoffene til silke.
Medisin
Decahrid natriumsulfat brukes som avføringsmiddel, siden det er lite absorbert i tarmen, og derfor forblir i lys av dette som forårsaker en økning i volum. Dette stimulerer økningen i peristaltiske sammentrekninger som induserer utvisning av tarminnhold.
Natriumsulfat er en motgift for å kontrollere forgiftning med barium og bly salter. Glaubert salt er effektivt for eliminering av visse medisiner i altfor inntatt; For eksempel paracetamol (acetoaminophen).
I tillegg brukes den til å levere dårlige elektrolytter med tilstedeværelse i isoosmotiske løsninger.
Tørkingsmiddel
Natriumsulfat fordi det er et inert reagens, brukes til fjerning av vann fra organiske forbindelsesløsninger.
Råmateriale
Natriumsulfat brukes som råstoff for produksjon av mange stoffer, inkludert: natriumsulfid, natriumkarbonat og ammoniumsulfat.
Kan tjene deg: gasskromatografiÅ skaffe
Natriumsulfat oppnås ved gruveekstraksjon og kjemiske reaksjoner.
Gruveutvinning
Det er tre malm eller mineraler som blir utnyttet med kommersiell ytelse: Thenardita (NA2SW4), Mirabilita (na2SW4· 10H2O) og glaubarita (na2SW4·Sak4).
I Spania utnyttes Thenardita og Mirabilita -forekomster av underjordisk gruvedrift av gallerier og søyler. I mellomtiden oppnås Glauberita i det fri, av store flåter som er plassert på mineraltanken.
Terrenget tilberedes med sprengning av lav intensitet for å produsere en porøsitet som tillater natriumsulfatutvasking. Produksjonsfasen oppstår med sprinkler irrigasjon med ferskvann fra glauberita, hvis utvasking forplanter seg på en synkende måte.
Natriumsulfatlake blir samlet, og kalsiumsulfatresten fylles.
Kjemisk produksjon
Natriumsulfat oppnås under produksjon av saltsyre gjennom to prosesser: Mannheim -prosessen og hardgrenave -prosessen.
Mannheim -prosessen
Det gjøres i store stålovner og med en 6 m stålreaksjonsplattform. Reaksjonen oppstår mellom natriumklorid og svovelsyre:
2 NaCl +H2SW4 => 2 HCl +Na2SW4
Hardreave prosess
Det innebærer reaksjon av natriumklorid, svoveloksid, oksygen og vann:
4 NaCl + 2 Så2 + ENTEN2 + 2 h2O => 4 hcl +na2SW4
Andre
Natriumsulfat forekommer i nøytraliseringsreaksjonen mellom natriumhydroksyd og svovelsyre:
2 NaOH +H2SW4 => Na2SW4 + H2ENTEN
Natriumsulfat er et biprodukt av produksjonen av mange forbindelser. Det trekkes ut fra flytende avfall som slippes ut under produksjonen av viskosen og cellofanen. Også i produksjonen av natriumdikromat, fenoler, borsyre og litiumkarbamat.
Risiko
Natriumsulfat regnes som en forbindelse med lav toksisitet. Imidlertid kan det gi noen skader på personen som bruker det upassende.
For eksempel kan du forårsake øyestridning, rødhet og smerte. I huden kan det forårsake irritasjon og allergi hos noen mennesker. Inntaket kan forårsake irritasjon i fordøyelseskanalen med kvalme, oppkast og diaré. Og til slutt gir innånding irritasjon i luftveiene.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Natriumsulfat. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). Natriumsulfat. PubChem -database. CID = 24436. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- B. N. Mehrotra. (1978). Krystallstrukturen til Na2SW4Iii. Gjenopprettet fra: rruff-2.geo.Arizona.Edu
- Glauberita-Thenardita (natriumsulfat). [PDF]. Gjenopprettet fra: igme.er
- « Sinkoksid (ZnO) struktur, egenskaper, bruksområder, risikoer
- Laktofenolblå egenskaper, sammensetning, forberedelse, bruk »

