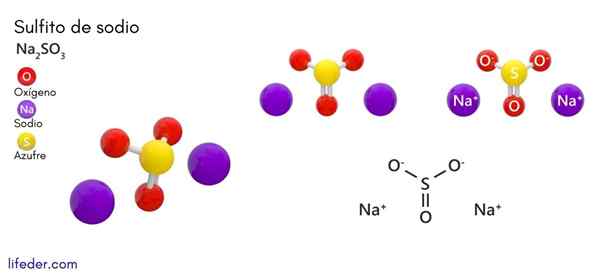
Natriumsulfitt (Na2SO3)
- 1350
- 87
- Magnus Sander Berntsen
Hva er natriumsulfitt?
Han natriumsulfitt eller natriumsulfitt, hvis kjemiske formel er Na2SW3, Det er et oppløselig natriumsalt som oppnås som et produkt av svovelsyre -reaksjon (eller svoveloksid (IV)) med natriumhydroksyd.
Mellom 1650 og 1660 begynte Glauber å produsere natriumsulfitt fra vanlig salt (NaCl) og konsentrert svovelsyre. Denne prosessen regnes som begynnelsen på den kjemiske industrien.
Sulfittprosessen produserer tremasse, som observeres som nesten ren cellulosefiber ved å bruke flere svovelsyresalter for å trekke ut ligninet til tresplinter.
Dermed har sulfitter et stort antall anvendelser av forskjellige typer, inkludert i matindustrien som tilsetningsstoff. Blant de mest relevante funksjonene, dens enzymatiske og ikke -enzymatiske bruning, kontroll og hemming av mikrobiell vekst, forebygging av oksidativ roting og modifisering av de reologiske egenskapene til mat.
Natriumsulfittforberedelse
Generelt, i laboratorieskala, oppstår natriumsulfitt fra reaksjonen av natriumhydroksydoppløsning med svoveldioksidgass (2NaOH + SO2 → Na2SW3 + H2ENTEN).
Så utviklingen av SO2 Ved å tilsette noen få dråper konsentrert saltsyre, vil det indikere om natriumhydroksyd nesten mangler, blir til vandig natriumsulfitt (NA2SW3 + 2HCl → 2NaCl + SO2 + H2ENTEN).
På den annen side oppnås denne kjemiske forbindelsen industrielt ved å reagere sulfiddioksid med en natriumkarbonatoppløsning.
Kan tjene deg: Spektral notasjonDen første kombinasjonen genererer natriumbisulfitt (NAHSO3), At ved å reagere med natriumhydroksid eller natriumkaroksyd, blir det omdannet til natriumsulfitt. Disse reaksjonene kan oppsummeres i den globale reaksjonen så2 + Na2Co3 → Na2SW3 + Co2.
Kjemisk struktur
Alle former av natriumsulfitt er preget av å være hvite, krystallinske og hygroskopiske faste stoffer, som har evnen til å lett tiltrekke og beholde vannmolekyler i det omkringliggende miljøet, som normalt er ved romtemperatur.
Den typen krystallinsk struktur er knyttet til tilstedeværelsen av vann i forbindelsen. Anhydrid natriumsulfitt presenterer en ortorrombisk eller sekskantet struktur, og i tilfelle det er tilstedeværelse av vannmolekyler i forbindelsen, endrer dens struktur (for eksempel heptahydrat natriumsulfitt presenterer en monoklinisk struktur).
Egenskaper
Denne arten har visse fysiske og kjemiske egenskaper som skiller den fra andre salter, som er beskrevet nedenfor:
Kjemiske egenskaper
Som mettet vandig løsning har dette stoffet en omtrentlig pH på 9. I tillegg oksiderer løsningene utsatt for luften til slutt natriumsulfat.
På den annen side, hvis natriumsulfitt av den vandige oppløsningen tillates å krystallisere ved romtemperatur eller lavere, gjør det det som et hepthydrat. Heptahydrats krystaller utlever i varm og tørr luft, de oksiderer også i luften for å danne sulfat.
I denne forstand er anhydraform mye mer stabil mot luftoksidasjon. Sulfitt er uforenlig med syrer, sterke oksidanter og høye temperaturer. Det er også uoppløselig i ammoniakk og klor.
Kan tjene deg: isopropylalkoholFysiske egenskaper
Anhydrid natriumsulfitt har en molmasse på 126,43 g/mol, en tetthet på 2 633 g/cm3, Et fusjonspunkt på 33,4 ° C (92,1 ° F eller 306,5 K), et kokepunkt på 1.429 ° C (2.604 ° F eller 1.702 K), og er ikke brennbar. Også løselighet (målt ved en temperatur på 20 ° C) er 13,9 g/100 ml.
Bruk/applikasjoner
På grunn av sine reaktive egenskaper er natriumsulfitt veldig allsidig og bruker for tiden vidt typer bransjer.
- Det er mye brukt i vannbehandling og eliminering av oppløst oksygen i vannkjeler.
- Den har også applikasjoner i papirindustrien (semi -Kid masse).
- I fotografering brukes det i produksjonen av avslørende.
- I passende grad brukes det i mat- og antioksidantbevaring.
- I tekstilindustrien brukes den i hvitvasking og antiklorprosesser.
- Det brukes også som et reduserende middel.
- I tillegg brukes det i sekundær utvinning av oljebrønner.
- Det brukes til og med i fremstilling av organiske forbindelser, fargestoffer, blekk, tyktflytende rayon og gummi.
- Det brukes i fremstilling av mange kjemikalier, inkludert kaliumsulfat, natriumsulfitt, natriumsilikat, natriumhyposulfitt og natriumaluminiumsulfat.
Risiko
Effekter for eksponering for forbindelse
Langvarig eller gjentatt eksponering for dette stoffet kan forårsake dermatitt og følsomhetsreaksjoner. Eksponering i sulfittfølsom, astmatisk og atopisk.
Tilsvarende kan syredekomponering av natriumsulfitt frigjøre giftig og farlig røyk av svoveloksider, inkludert svoveldioksid, som kan forårsake permanent lungekrop på grunn av kronisk og akutt eksponering.
Kan tjene deg: Ididio 192Tilsvarende er akutt forgiftning med svoveldioksid sjelden fordi gass lett oppdages. Det er så irriterende at kontakten ikke kan tolereres.
Blant symptomene er hoste, rykte, nysing, riving og pustevansker inkludert. Imidlertid kan ansatte med høy uunngåelig eksponering lide viktig og muligens dødelig lungeskade.
Økotoksisitet
Natriumsulfitt er en ikke -hazardøs løsning, som ofte brukes som et gjenværende vannnedgangsmiddel. Høye konsentrasjoner bidrar til høy etterspørsel etter kjemisk oksygen i vannmiljøer.
Matforbruk med konserveringsmidler
Et av tilsetningsstoffene som kan forårsake problemer hos sensitive mennesker er gruppen kjent som sulfitasjonsmidler, som inkluderer flere sulfitt uorganiske tilsetningsstoffer (E220-228), inkludert natriumsulfitt (så2).
I overfølsomme eller astmatiske mennesker, forbruk av mat med sulfitter eller innånding av svoveldioksid, kan det være giftig.
Disse forbindelsene er ansvarlige for bronk-konferanse som oversettes til pustevansker. Den eneste behandlingen for denne overdreven reaksjonen er å unngå mat og drikke som inneholder sulfitter.