Aromatisk elektrofil substitusjonsmekanisme og eksempler

- 1428
- 75
- Markus Fredriksen
De Aromatisk elektrofil substitusjon (Sear) Det er en organisk reaksjon der en dårlig art i elektroner, det vil si en elektrofi, erstatter et av hydrogenene i en aromatisk ring. Denne reaksjonen er i motsetning til tilsetningene som alkener har lidd, og viser effekten av aromatitet på reaktivitetene til benzen og dens derivater.
Elektrofilen genereres mange ganger under den samme molekylære mekanismen, produktet av blandingen av reagensene og en katalysator, som består av en syre av Lewis, for eksempel alt3 eller fecl3. Disse katalysatorene øker aviditeten til elektrofilen av elektronene i den aromatiske ringen, og akselererer dermed reaksjonen.
 I den aromatiske elektrofile substitusjonen er det benzenringen som angriper elektrofilen. Kilde: Gabriel Bolívar via Molview.
I den aromatiske elektrofile substitusjonen er det benzenringen som angriper elektrofilen. Kilde: Gabriel Bolívar via Molview. I det overordnede bildet har vi en enkel representasjon av det elektrofile angrepet av benzen mot elektrofilen og+. Merk at angrepet kommer fra elektronene til en av dobbeltbindingene; det vil si at det er elektronene til det konjugerte π -systemet som starter sear.
Denne reaksjonen gjør det mulig for benzen og andre aromatiske forbindelser å skaffe seg substituenter som OH -grupper, ikke2, SW3H, CL, BR, R, Cor, Coch3, blant andre. For eksempel syntetiseres fenolen via sear fra benzen og andre derivater.
[TOC]
Aromatisk elektrofil substitusjonsmekanisme
Trinn 1: Elektrofylisk angrep
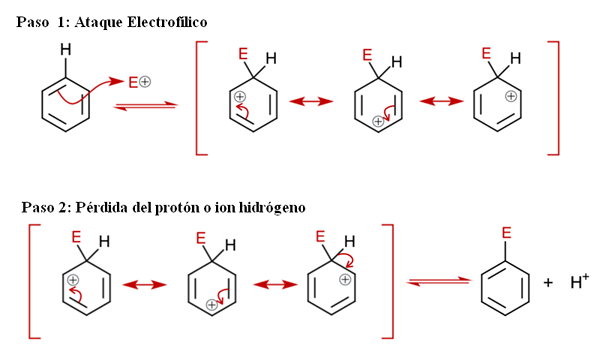 Generell mekanisme for sear. Kilde: Soonlorpai via Wikipedia.
Generell mekanisme for sear. Kilde: Soonlorpai via Wikipedia. I det overlegne bildet er mekanismen for aromatisk elektrofil substitusjon representert mer detaljert. Noen av de tre dobbeltbindingene av benzenangrep elektrofilen og+, For å danne en mellomliggende art kjent som Ion Arenio (delokalisert cyclohexadien), låst i røde parenteser.
Kan tjene deg: kjemisk nedbørLegg merke til at den positive belastningen på e+ Gå nå til det indre av ringen. Men ikke bare det: det flytter mellom tre karbonatomer i orto (tilstøtende) posisjoner og for (motsatt) til karbon knyttet til E (C-E). Denne mellomledd eksisterer nettopp takket være stabiliteten som er gitt av dens resonansstrukturer.
Trinn 2: Tap av proton eller hydrogenion
Arenio -ionet må imidlertid snart nøytralisere sin positive belastning ved å tape et hydrogenproton eller ion. Det er her erstatning kulminerer. Elektrofilen e+ erstatter derfor et av benzenhydrogenene, og etterlater dette som ion h+ utenfor ringen, slik at positive ladninger er bevart.
Hvis det observeres nøye, er alle trinnene i likevekt, så erstatningen er reversibel. Det vil si hvis konsentrasjonene av H økes+, da vil et hydrogen erstatte E, og vi får reagensene igjen.
Eksempler på aromatisk elektrofil substitusjon
Benzen
Benzen Sear er den enkleste av alle, allerede representert ovenfor. Noen av hydrogenene kan erstattes av e+, Fordi alle er kjemisk likeverdige.
Det er ingen forskjeller fra hverandre. Derfor er sannsynligheten for at erstatning skjer i et av de seks karbonatomene den samme. Imidlertid endres alt når det er andre substituenter som er til stede i Benzenic Ring, som vi vil se nedenfor.
Fenol
Orto, for og målangrep
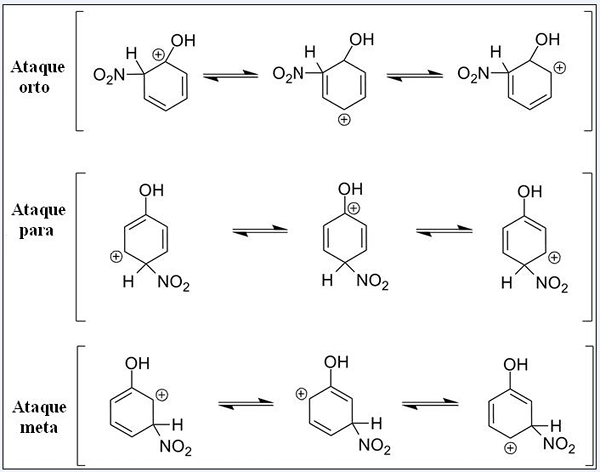 Resonansstrukturer for fenol i sin aromatiske elektrofile substitusjonsreaksjon. Kilde: Pete Davis, Public Domain, via Wikimedia Commons
Resonansstrukturer for fenol i sin aromatiske elektrofile substitusjonsreaksjon. Kilde: Pete Davis, Public Domain, via Wikimedia Commons Tenk nå på sear for fenol. Denne gangen er elektrofi den nitroniske kationen, ikke2+, som når man kobler til benzenringen blir omgjort til nitro -gruppen, -no2.
Kan tjene deg: nitrater: egenskaper, struktur, nomenklatur, treningNå som en OH -gruppe er til stede, slutter de andre hydrogenene å være kjemisk likeverdige; Noen er mer utsatt for å bli erstattet enn andre. Og i tillegg utøver Oh en direkte innflytelse på dette tidspunktet.
Opp har vi tre erstatninger i forskjellige stillinger relatert til OH: Ortho -angrep, for og mål. Legg merke til at i alle tre har vi sandkationene og dens resonansstrukturer. I ortho -angrepene og for er den positive belastningen inne i benzenringen plassert rett i karbonet knyttet til OH; Mens du er i målangrepet, skjer ikke dette.
Å som en orto -gruppe og for regissør
Oh presenterer evnen til å gi elektroner til ringen via resonans og induksjon. I begge kan det bidra til å "spre" den positive belastningen i karbonet det er koblet sammen med, og stabiliserer seg deretter strukturen. Tvert imot, når målangrepet oppstår, kan ikke OH stabilisere den positive belastningen på samme måte, og strukturen er mer ustabil.
Derfor er ortho -angrep og for mer energi favorisert. Det sies da at OH er en orto-for-regissørgruppe, som også kan aktivere Benzenic Ring mot Sear. Det vil si at fenolen reagerer mye raskere enn benzen, som demonstreres ved å måle reaksjonshastigheter.
Arilaminer
 Resonansstrukturer for anilin i sin aromatiske elektrofile substitusjonsreaksjon. Kilde: V8rik på engelsk Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Resonansstrukturer for anilin i sin aromatiske elektrofile substitusjonsreaksjon. Kilde: V8rik på engelsk Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Tilfellet med arilaminene, som anilin (overlegen bilde), ligner på fenol. Legg merke til at i sin mekanisme denne gangen stabiliseringen av den positive belastningen på nitrogenatom (H2N+=), hjelpe erstatningen for å bli orientert mot orto -stillinger og for, som med OH.
Det kan tjene deg: Acid-Bass Theories: Arrhenius, Bronsted-Lowry, LewisNå er anilin mer reaktiv enn fenol mot elektrofil substitusjon. Fordi? Fordi nitrogenatomet er mindre elektronegativt enn oksygen, og det er grunnen til at det gir paret gratis elektroner lettere til den aromatiske ringen. Oksygen, fordi det er mer elektronegativ, gir et av elektronparene med mindre "aviditet".
Også atomradius av nitrogen er nærmere i størrelse med karbon. Dette har innvirkning på det faktum at resonans foregår spesielt mellom atomer med lignende radioer eller størrelser. Derfor er resonansen mellom karbon og nitrogen litt mer stabilt og effektivt enn den mellom karbon og oksygen.
Klorbenzen
I klorbenzen, derimot, bremser CL substitusjonen på grunn av elektronegativiteten. Og selv om det også er i stand til å donere elektroner på grunn av resonans til ringen, er dens atomradius betydelig større enn karbonens, og reduserer derfor nevnte elektronisk bidrag.
Som svar reagerer klorbenzen 50 ganger tregere enn benzen, da ringen er deaktivert på grunn av klor. Og også å tiltrekke elektroner mot seg selv, er klor en målgruppe, så det vil forekomme substitusjoner hovedsakelig i den posisjonen.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatisk forbindelse. Hentet fra: i.Wikipedia.org
- Ed Vitz et al. (8. september 2020). Aromatiske hydrokarboner. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Wyman Elizabeth. (2020). Aromatiske hydrokarboner: Definisjon, eksempel og bruk. Studere. Gjenopprettet fra: Studie.com
- Boluda, ca. J., Macías, m., & González Marrero, J. (2019). Den kjemiske kompleksiteten til bilbensin. Vitenskap, ingeniørfag og applikasjoner,2(2), 51-79. Doi: doi.org/10.22206/Cyap.2019.V2i2.PP51-79
- « Termiske energiegenskaper, innhenting, overføring
- Aluminiumoksydstruktur, egenskaper, bruksområder, nomenklatur »

