Aluminiumoksydstruktur, egenskaper, bruksområder, nomenklatur
- 4715
- 136
- Thomas Karlsen
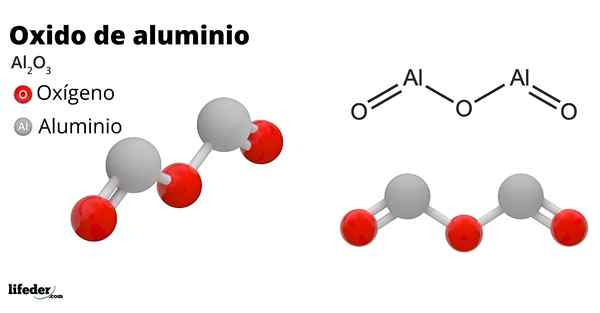
Han aluminiumoksid, Også kalt aluminiumoksyd, aluminiumoksid, korindon eller aluminiumtrioksid, det er en uorganisk forbindelse hvis kjemiske formel er til2ENTEN3. Det er et amfotero -oksid, selv om det kan bli, på grunn av behandling, en nesten inert forbindelse.
Det har stor hardhet, korrosjonsmotstand og høy elektrisk motstand. Disse egenskapene har blant annet tillatt aluminiumoksyd å ha mange anvendelser, for eksempel: elektrisk isolasjon, slipemateriale, bein- og tennimplantater, etc.
Bauxitt er hovedkilden for å oppnå aluminiumoksyd. Corindon er derimot et mineral av aluminiumoksyd som er i fri tilstand i form av α-Al2ENTEN3. Corindon har en hardhet på 9.0, og på grunn av noen urenheter produserer det edelstener, som safir og rubin.
Aluminiumoksydelektrolyse tjente som grunnlag for aluminiumisolasjon av Humphry Davy i 1808. Den samme metoden, med noen tilpasninger, brukes for tiden i metallisk aluminiumsproduksjon.
[TOC]
Struktur
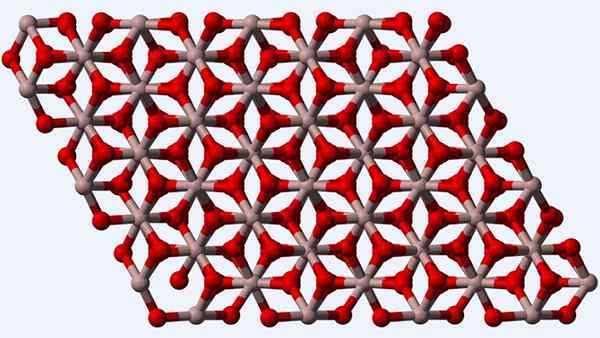 Krystallinsk struktur av α-Al2O3 eller Corindon-fasen
Krystallinsk struktur av α-Al2O3 eller Corindon-fasen Corindon eller α-al-fasen2ENTEN3, Fordi det er termodynamisk mer stabilt polymorf for aluminiumoksyd, blir dens struktur (overlegen bilde) betraktet som det viktigste på tidspunktet for karakteriseringen. Denne strukturen er trigonal, med ionene til3+ omgitt av seks eller2-, og derfor å etablere octaedros al6 med interaksjoner al-o u al-o.
I tillegg til Corindón, Al2ENTEN3 Det eksisterer også som andre metastabile polymorfer, inkludert: y-al2ENTEN3 og η-al2ENTEN3 (kubikk), θ-at2ENTEN3 (monoklinisk), χ-al2ENTEN3 (sekskantet), κ-al2ENTEN3 (Ortorrombic) og Δ-al2ENTEN3 (Tetragonal eller Ortorrombic).
Som Al2ENTEN3, Oktaedraen "bryter" i Tetrahedros al4 o Pentaedros alo5. Når du er smeltet og avkjølt igjen, kan du få et glassaktig aluminiumoksyd, det vil si amorf, med blandinger av polyhedra alm5 og alt6.
Det kan tjene deg: Einstenio (er): Struktur, egenskaper, innhenting, brukAluminiumoksydegenskaper
 Aluminiumoksidbelegg smeltet metall aluminiumsstykker
Aluminiumoksidbelegg smeltet metall aluminiumsstykker Fysisk utseende
Fast eller hvitt krystallinsk pulver
Molmasse
101.96 g/mol
Lukt
Toalett
Tetthet
3.798 g/cm3
Smeltepunkt
2072 ºC
Kokepunkt
2977 ºC
Løselighet
Uoppløselig i alle løsningsmidler, inkludert vann.
Termisk ledningsevne
30 w · m-1· K-1. Til tross for keramisk bruk, har den en relativt høy varmeledningsevne.
Brytningsindeks
1.768-1.760
Hardhet
Det er en forbindelse som presenterer en veldig høy hardhet, med en verdi på 9.0 på Mohs Hardness-skalaen i form av α-aluminiumoksyd (Corindón).
Elektrisk resistivitet
Ved 300 ° C: 1.2 x 101. 3 Ohm · cm. Aluminium eller aluminiumoksyd er derfor en elektrisk isolator.
Reaktivitet
Al2ENTEN3 Til tross for å reagere svakt med alkalier, og i større grad med syrer, regnes det som en kjemisk amfoter. Imidlertid, når den blir oppvarmet ved mer enn 800 ° C, får den en nesten inert tilstand til virkning av syrer.
Dette oksid.
Nomenklatur
Nomenklaturen til al2ENTEN3 det er enkelt. Systematisk kjent som diauminium trioksid. Ettersom dette aluminiumoksydet eksisterer, er ikke metallet Valencia (III) i sin aksje nomenklatur. Navnet er også tradisjonelt oppsummert til aluminiumoksyd, ved bare å ha en valens.
Bruk/applikasjoner
Glass
Aluminiumoksyd griper inn i utdyping av aluminium-silicato-glass. Dette ildfaste glasset, motstandsdyktig mot termisk sjokk, kan brukes ved høyere temperaturer enn bor-silikatglass; Selv om det har lavere kjemisk motstand.
Tilsetningen av en liten mengde magnesia forvandler det ugjennomsiktige glasset aluminiumoksyd til gjennomskinnelig, og kan brukes som en gassbeholder i natriumdamppærer med høyt trykk. Det brukes også i fremstilling av beleggsuspensjoner av visse typer lysstoffrør lamper.
Kan tjene deg: Rodio: Historie, egenskaper, struktur, bruk, risikoKatalysator
Aktivert aluminiumoksyd har en kornet og porøs karakteristikk som kan ha katalytisk aktivitet, eller tjene som en støtte for aktiviteten til andre katalysatorer. Blant andre prosesser griper aluminiumoks.
Mikrobicidal aktivitet
Nano-aluminiumoksydpartikler fester seg til bakterienes overflate, og forårsaker deres død. På samme måte har en lignende effekt på soppen til Candida -slekten blitt bevist.
Elektrisk isolator
Aluminiumoksyd har en høy elektrisk resistivitet, noe som gir den muligheten til å fungere som en elektrisk isolator. Derfor brukes den i integrerte kretspakker. Det brukes også i superlederenheter, og som dielektrisk kondensator eller kondensatorer. I tillegg brukes den som en isolator i elektriske tennplugger.
Slipende
 Corindon, det krystallinske og tøffere av aluminiumoksyd, tjener til å bygge slipende verktøy. Kilde: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0, CC By-SA 3.0, via Wikimedia Commons
Corindon, det krystallinske og tøffere av aluminiumoksyd, tjener til å bygge slipende verktøy. Kilde: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0, CC By-SA 3.0, via Wikimedia Commons Den høye hardheten i Corindon -mineral.
Corindon får den edle steinformen, for eksempel den røde rubinen, på grunn av kromforurensning; eller som blå safir, på grunn av jern- og titanforurensning. Mange typer sandpapir brukt i metall og tre har aluminiumoksydkrystaller.
Iherdighet eller evne til å unngå brudd på aluminiumoksyd øker med tilsetning av zirkonium. I tillegg brukes aluminiumoksyd i tannkremer for polering av tenner.
Kan tjene deg: sinkkromat: struktur, egenskaper, innhenting, brukOgså noen presentasjoner av aluminiumoksyd brukes som slipemidler av hudleger i behandlingen av visse hudforhold.
Gassavfukter
Aluminiumoksyd er en forbindelse med ivrig med vann, så det kan brukes til å trekke den ut fra gassformige strømmer.
Flammehemmende
Nanopartiklene av aluminiumoksydhydroksyd (Bohemita) fungerer som en varmedissipator, slipper vann og forsinker flamens utseende.
Hard vevsimplantater
Aluminiumoksyd er en forbindelse med stor hardhet, kjemisk inert og korrosjonsbestandig, i tillegg til å ha en hvit farge. For disse egenskapene brukes det som en erstatning for hardt vev som bein og tenner. På samme måte har materialet bygget med aluminiumoksyd blitt brukt i leddserstatning.
Å skaffe
 Bauxittprøve. Kilde: Maks.Kit, CC By-SA 4.0, via Wikimedia Commons
Bauxittprøve. Kilde: Maks.Kit, CC By-SA 4.0, via Wikimedia Commons Bauxitten er det viktigste mineralet for å oppnå aluminiumoksyd, og dannes ved blandingen av tre mineraler: Gibbsite, Laboehmita og diaspora.
Aluminiumoksyd trekkes ut fra sineralene ved Bayer -prosedyren. Dette består av den varme bauxittreaksjonen med natriumhydroksyd, en reaksjon produsert ved natriumaluminat [Naal (OH)4].
Når den forrige løsningen er avkjølt, produseres nedbør av aluminiumhydroksyd i fast form. Deretter varmes dette hydroksydet til 1100 ° C, og produserer aluminiumoksyd.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Oksidaluminium. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Oksidaluminium. Pubchem Comunund sammendrag for CID 9989226. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Kushagri s. et al. (2019). Antiviral og antimikrobiell potensialitet av nano medisiner: nanopartikkel aluminiumoksyd. Hentet fra: Scientedirect.com
- Redaktørene av Enyclopaedia Britannica. (2020). Aluminiumoksyd. Gjenopprettet fra: Britannica.com
- Lohninger Hans. (15. august 2020). Oksidaluminium. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Aromatisk elektrofil substitusjonsmekanisme og eksempler
- 30 eksempler på etikk og moral i dagliglivet »

