Haveteori om elektronens grunnleggende og egenskaper
- 1544
- 220
- Jonathan Moe
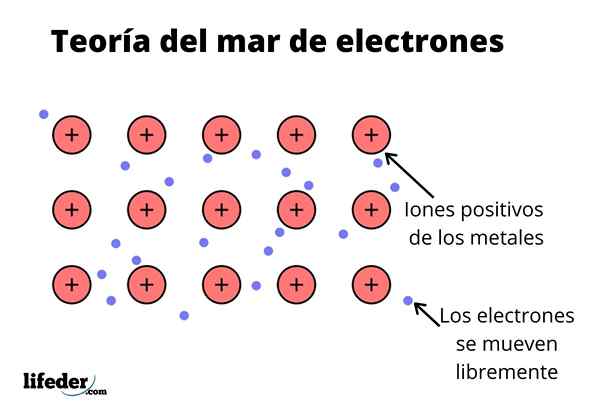
De Electron Sea Theory Det er en hypotese som forklarer et eksepsjonelt kjemisk fenomen som oppstår i metallbindinger mellom elementer med lave elektronegativiteter. Dette er deling av elektroner mellom forskjellige forente atomer gjennom metallbindinger.
Den elektroniske tettheten mellom disse bindingene er slik at elektronene flyttes og danner et "hav" der de beveger seg fritt. Det kan også uttrykkes av kvantemekanikk: noen elektroner (det er vanligvis en til syv per atom) er anordnet i orbitaler med flere sentre som er strukket av den metalliske overflaten.
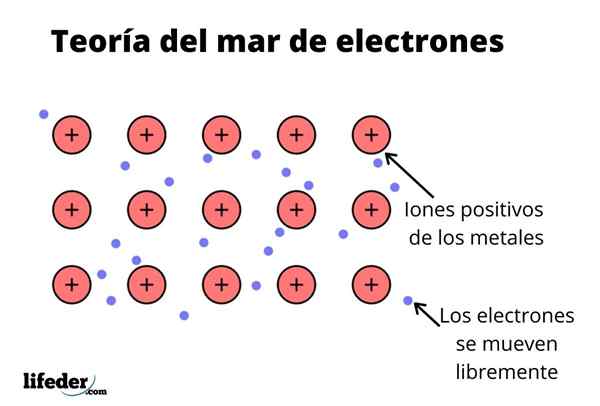
Elektroner beholder også noe sted i metall, selv om sannsynlighetsfordelingen av den elektroniske skyen har større tetthet rundt noen spesifikke atomer. Dette er fordi når en spesifikk strøm blir brukt, manifesterer de ledningsevnen i en spesifikk retning.
[TOC]
Fundamentals of Electron Sea Theory
Metallelementer har en stor tendens til å donere elektroner på sitt siste energinivå (valenslag), på grunn av deres lave ioniseringsenergi i forhold til de andre elementene.
Når vi vet dette, kan hvert metallelement betraktes som en kation knyttet til elektronet på det siste energinivået, noe som vil være mer utsatt for å donere.
Som i et metall er det et stort antall atomer som er knyttet til hverandre, kan det antas at dette metall.
Tatt i betraktning at de elektrostatiske attraksjonskreftene mellom kationen (positiv belastning) og elektronet (negativ belastning) har atomene i metall.
Kan tjene deg: polymererPå denne måten kan det utledes at jo større antall elektroner som er til stede i Valencia -laget av et metall, denne typen elektrostatisk lim vil ha større styrke.
Egenskaper
Elektronhavsteorien gir en enkel forklaring på egenskapene til metallarter som motstand, konduktivitet, duktilitet og formbarhet, som varierer fra et metall til et annet.
Det har blitt oppdaget at motstanden som er gitt til metaller skyldes den store flyttingen av elektronene deres, som genererer en veldig høy samholdskraft mellom atomene som danner den.
På denne måten er duktilitet kjent som evnen til visse materialer til å tillate deformasjon av strukturen deres, uten å gi nok til å bryte, når de blir utsatt for visse krefter.
Delokalisering i form av lag
Både duktilitet og formbarhet av et metall bestemmes av det faktum at Valencia -elektroner blir demokert i alle retninger i form av lag, noe som får dem dens deformasjon.
På samme måte tillater bevegelsesfriheten til flyttede elektroner en strøm av elektrisk strøm, noe som fører til at metaller har veldig god elektrisitetsledningsevne.
I tillegg tillater dette fenomenet fri bevegelse av elektroner overføring av kinetisk energi mellom de forskjellige metallregionene, som fremmer varmeoverføring og får metaller til å manifes.
Det kan tjene deg: Jodosesyre (HIO2): Egenskaper og bruksområderElektroner Sea Theory in Metal Crystals
Krystaller er faste stoffer som har fysiske og kjemiske egenskaper - som tetthet, smelting og hardhetspunkt - som er etablert av den typen krefter som gjør at partiklene som omfatter dem holdes sammen.
På en måte anses det at metallkrystaller har de enkleste strukturene, fordi hvert "punkt" i glassnettet har vært okkupert av et atom i selve metallet.
I samme forstand har det blitt bestemt at strukturen til metallkrystaller generelt er kubikk og fokuserer på ansikter eller kropp.
Imidlertid kan disse artene også ha en sekskantet form og ha en ganske kompakt emballasje, noe som gir dem den enorm tetthet som er karakteristisk for dem.
På grunn av denne strukturelle grunnen er koblingene som er dannet i metallkrystaller forskjellige fra de som forekommer i andre klasser av krystaller. Gjennom den krystallinske strukturen er elektroner som kan danne bindinger, som forklart ovenfor, tidligere forklart.

Ulemper med teorien
I metallatomer er det en liten mengde valenselektroner i forhold til energinivået deres; Det vil si at det er en større mengde energitilstander tilgjengelig enn mengden koblede elektroner.
Dette innebærer at ettersom det er en sterk elektronisk flytting og også energibånd som delvis har fylt, kan elektroner bevege seg gjennom retikulærstrukturen når de blir utsatt for et elektrisk felt fra utlandet, i tillegg til å danne elektronhavet som innrømmer permeabiliteten til nettverket.
Kan tjene deg: oxácidoSå foreningen av metaller blir tolket som et konglomerat av positive ioner koblet av et hav av elektroner (negativ belastning).
Imidlertid er det egenskaper som ikke blir forklart gjennom denne modellen, for eksempel dannelse av visse legeringer mellom metaller med spesifikke komposisjoner eller stabiliteten til kollektive metallforbindelser, blant andre.
Disse ulempene forklares med kvantemekanikk, fordi både denne teorien og mange andre tilnærminger er etablert basert på den enkleste modellen av et enkelt elektron, mens de prøver å gjelde i mye mer komplekse strukturer av multielektroniske atomer.
Referanser
- Wikipedia. (2018). Wikipedia. Innhentet fra.Wikipedia.org
- Holman, J. S., Og stein, s. (2001). Kjemi. Gjenopprettet fra bøker.Google.co.gå
- Parkin, g. (2010). Metallmetallbinding. Gjenopprettet fra bøker.Google.co.gå
- Rohrer, g. S. (2001). Struktur og binding i krystallinske materialer. Gjenopprettet fra bøker.Google.co.gå
- Ibach, h., og Lüth, h. (2009). Solid-State Physics: An Introduction to Principles of Materials Science. Gjenopprettet fra bøker.Google.co.gå

