Kaliumbromid (KBR) struktur, egenskaper, bruk
- 1121
- 152
- Prof. Theodor Gran
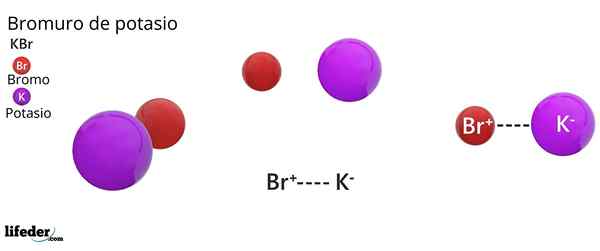
Han Kaliumbromid Det er et uorganisk salt hvis kjemiske formel er KBR. Det er dannet av den elektrostatiske foreningen av en bromidanion, BR-, Og en kaliumkation, k+, i en 1: 1 -andel; det vil si at vi har samme mengde BR- som av k+ I KBR -krystaller.
Kaliumbromid er et fast hvitt eller krystallinsk salt, det er luktfritt, veldig løselig i vann og lite oppløselig i etanol og etanol. Den ble brukt i løpet av den siste delen av 1800 -tallet og store deler av det tjuende århundre i behandlingen av epilepsi og som beroligende middel.
Fram til 1975 fortsatte det å selge fritt, året bruken avtok på grunn av de giftige effektene det ga på pasienter. For øyeblikket brukes den fremdeles i flere arter av dyr i behandlingen av anfall, selv om det fra 1912 ble erstattet av natriumfenobarbital.
Kaliumbromid brukes i optiske studier som tilsvarer det nærliggende infrarøde området av det elektromagnetiske spekteret. Det fungerer også som materiale som brukes innen fotografering.
[TOC]
Link Type
Kaliumbromid er et binært salt, produkt av kombinasjonen av et bromatom med en oksidasjonstilstand -1, med et kaliumatom med en oksidasjonstilstand +1. Derfor etableres en elektrisk attraksjon mellom Ion BR- Og kionen+.
Denne typen elektrisk eller elektrostatisk interaksjon er kjent som en ionisk binding, som dissosierer når kaliumbromidsalt oppløses i vannet, og frigjør k -ionene+ og Br-.
Disse ionene blir oppløst av vannseiere.
Kaliumbromidstruktur
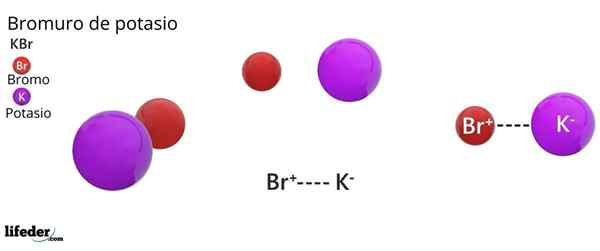
 Krystallstruktur FCC av KBR: De brune kulene tilsvarer BR-, mens de fiolette kulene tilsvarer kationene k+
Krystallstruktur FCC av KBR: De brune kulene tilsvarer BR-, mens de fiolette kulene tilsvarer kationene k+ Kaliumbromid presenterer en kubikk krystallinsk struktur sentrert i ansiktet (FCC) Ansiktssenteret kubikk), lik det som er observert i natriumklorid.
Kan tjene deg: Faraday konstantI denne strukturen er hver anion BR- Den er koblet eller koordinert med seks K -kationer+, Og på sin side hver k+ Den har seks BR- Som naboer i krystallinske nettverk.
Nomenklatur
Kaliumbromid er klassifisert som et halogenid eller alkalisk metallhalogenid. Navnene på disse saltene er konstruert ved å eliminere den endelige bokstaven med halogens navn (klor, brom, jod, fluor og astato), med unntak av fluor, og erstatte den endelige bokstaven med suffikset -euro. Navnet på metallet er skrevet nedenfor uten modifisering.
For eksempel: natriumklorid, kaliumjodid, kalsiumfluorid, etc. Det er grunnen til at KBR kalles kaliumbromid eller kaliumbromid (i henhold til den tradisjonelle nomenklaturen).
Kaliumbromidegenskaper
 Klokkeskive med KBR -granuler. Kilde: Walkerma via Wikipedia.
Klokkeskive med KBR -granuler. Kilde: Walkerma via Wikipedia. Fysisk utseende
Fargeløst glass, krystallinske eller hvite granuler.
Lukt
Toalett
Smak
Ved høy konsentrasjon har den en bitter og krydret smak.
Molmasse
119.02 g/mol
Tetthet
2.74 g/cm3 ved 25 ºC
Smeltepunkt
734 ºC
Kokepunkt
1435 ºC
Vannløselighet
535 g/l a 0 ºC
678 g/l a 25 ºC
1020 g/l a 100 ºC
1 gram saltet oppløses i 1 ml kokende vann, noe som indikerer at det er veldig løselig i vann.
Løselighet i glyserol
217 g/l
1 gram kaliumbromid oppløses i 4.6 ml glyserol.
Etanolløselighet
47.6 g/l a 80 ºC.
1 gram kaliumbromid oppløses i 250 ml etanol.
Damptetthet
7.14 i luftforhold tatt som enheten.
Stabilitet
Stabil hvis det er lagret under de anbefalte forholdene. Uforenlig med oksidasjonsmidler, sterke syrer, brom trifluorid og brom.
Nedbrytning
Når det blir oppvarmet til nedbrytning avgir skadelige produkter, for eksempel hydrogenbromid og kaliumoksyd.
Kan tjene deg: Kernel elektronisk konfigurasjon: konstruksjon, eksemplerRefraction Index (ND)
1.559
Ph
I vandig løsning produserer en nøytral pH, rundt 7.
tenningspunkt
1435 ºC
Oppløsning og reaktivitet
I vandig løsning er KBR fullstendig dissosiert for å forårsake en nøytral pH -løsning.
Salt er en kilde til bromid som kan brukes til sølvbromidproduksjon, AGBR, forbindelse som brukes i utviklingen av fotografier:
Kbr (ac) +agno3 (AC) → AGBR (S) +KNO3 (AC)
KBR er også et svakt reduserende middel, uforenlig med kvikksølv og sølvsalter. Produserer en voldelig reaksjon med brom trifluorid. Kan reagere med mange salter, alkaloider og stivelse.
Den reagerer også med syrer, for eksempel med konsentrert svovelsyre, og frigjør hydrogenbromid.
applikasjoner
Epilepsi og anfallsbehandling
De antikonvulsive egenskapene til kaliumbromid ble først utsatt av Sir Charles Locock, på et møte i Royal Medicine and Chirugical Society i 1857, som fremmet bruken av den i behandlingen av epilepsi.
Kaliumbromid ble brukt som prioritert medisinering i behandlingen av epilepsi og som beroligende middel til 1912, da natriumfenobarbitalen ble kunngjort.
Likevel ble det fortsatt å bli brukt som et supplement til natriumfenobarbital i behandlingen av anfall av epilepsi.
I 1975, på grunn av sin giftige karakter, FDA U.S. (Food & Drug Administration) bestemte seg for ikke å anbefale bruk av kaliumbromid, både hos mennesker og dyr. Noen land fortsatte imidlertid å administrere det.
Kaliumbromid ble brukt som hypnotisk og beroligende hos storfe, hester, sauer og griser. Det ble også brukt i behandlingen av kolikk og tetania hos hester, og i behandlingen av anfall hos hunder.
Infrarød optikk
På grunn av transparensen til kaliumbromidet i en rekke bølgelengder mellom det ultrafiolette lyset og den nærmeste infrarøde, brukes det som en komponent av vinduene for flere elektromagnetiske strålinger, spesielt infrarød stråling.
Kan tjene deg: osmolaritetFlere teknikker brukes i denne forbindelse. En av dem består i utdyping av to krystallinske plater av kaliumbromid, og plasserer en film av materialet som skal analyseres i det infrarøde i albumene. Studiene er utført i nær infrarød mellom 780 nm og 3000 nm.
Fotografi
 KBR var en del av materialene som ble brukt til å behandle de første fotografiene fra det tjuende århundre
KBR var en del av materialene som ble brukt til å behandle de første fotografiene fra det tjuende århundre Kaliumbromid har hatt mange bruksområder og applikasjoner innen fotografering, for eksempel: det har blitt brukt til å formulere fotograferingsutviklere, i produksjonen av fotografiske filmer, som et filmstykk, og som fargebleke i farge.
Det brukes i forbedring av differensieringen mellom sølvhalogenidekrystallene som er utsatt og ikke utsatt, i økningen i utskriftstettheten til tynne negativer, og som et sekundært halogenid, i kombinasjon med jodider, for behandling av negativ papir på papir.
Det har også blitt brukt i kombinasjon med kvikksølvbiklorid, kobbersulfat eller kaliumferikerurio i fotografiske blekere. Det har også fungert som en begrenser i alkaliske utviklere som brukes til gelatinplater og utviklingspapirer.
Kjemisk analyse
KBR brukes til å bestemme vurderingen av kobber og sølv, i den polarografiske analysen av indianeren, kadmium og arsen.
Andre bruksområder
Det brukes i litografi -graveringsprosesser, i oljebehandling, i termisk stabilisering av nylonet, i fremstilling av fibre, og til slutt i fremstilling av spesielle såper.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kjemi (Femte utg.). Pearson Prentice Hall.
- Wikipedia. (2020). Kaliumbromid. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2021). Kaliumbromid. Pubchem Comunund sammendrag for CID 253877. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- EMEA. (1999). Bromide, kaliumsalt: Sammendragsrapport. [PDF]. Gjenopprettet fra: EMA.Europa.EU
- Sevier b.V. (2020). Kaliumbromid. Scientedirect. Hentet fra: Scientedirect.com

