Etyleter

- 3620
- 222
- Dr. Andreas Hopland
 Etyleteren er en flyktig og brennbar væske som fungerte som bedøvelse i det nittende århundre
Etyleteren er en flyktig og brennbar væske som fungerte som bedøvelse i det nittende århundre Hva er etyleter?
Han etyleter, Også kjent som4H10ENTEN. Det er preget av å være en fargeløs og flyktig væske, og derfor må flaskene holdes lukket så tett som mulig.
Denne eteren. Det vil si at de har ROR -formelen ', der R og R' representerer forskjellige kullsyreholdige segmenter. Og som beskrevet med det andre navnet, er Dietl Ether, to radikaler -etyl som er knyttet til oksygenatom.
Opprinnelig ble etyleteren brukt som en generell bedøvelse, introdusert i 1846 av William Thomas Green Morton. På grunn av dens brennbarhet ble bruken imidlertid kastet, og erstattet den med andre mindre farlige bedøvelsesmidler.
Denne forbindelsen har også blitt brukt til å beregne blodsirkulasjonstid, under evalueringen av pasientkardiovaskulær status.
Etyleterstruktur
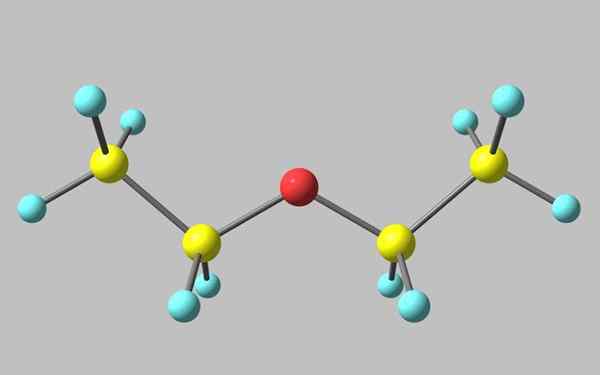 Kjemisk struktur av etyleter
Kjemisk struktur av etyleter I det overlegne bildet er det en representasjon med en modell av kuler og stenger i molekylstrukturen til etyleteren.
Som det kan sees, har den røde sfæren, tilsvarende oksygenatom, to etylgrupper knyttet til begge sider. Alle koblinger er enkle, fleksible og fri rotasjon rundt aksene σ.
Disse rotasjonene stammer fra stereoisomerer kjent som konformere, som mer enn isomerer er alternative romlige tilstander. Bildestrukturen tilsvarer nøyaktig anti -konform, der alle dens atomgrupper er forskjøvet (atskilt fra hverandre).
Den andre Concruero er formørket, og selv om det ikke er det tilgjengelige bildet, er det nok til å visualisere det med en U -formet. I de øvre ender av U ville metylgruppene være lokalisert, -CH3, som vil oppleve steriske frastøtninger (de ville kollidere i verdensrommet).
Kan tjene deg: Faraday konstantDerfor kan det forventes at Cho's molekyl3Ch2Och2Ch3 adoptere anti -formasjon mesteparten av tiden.
Fysiske og kjemiske egenskaper til etyleter
Andre navn
- Dietyleter
- Etoxytano
- Etyloksid
Molekylær formel
C4H10O o (c2H5)2ENTEN.
Molekylær vekt
74.14 g/mol.
Fysisk utseende
Fargeløs væske.
Lukt
Søt og krydret.
Smak
Brenn og søt.
Kokepunkt
94.3 ° F (34.6 ° C) ved 760 mm Hg.
Smeltepunkt
-177.3 ° F (-116.3 ° C). Stabile krystaller.
tenningspunkt
-49 ° F (lukket beholder).
Vannløselighet
6.04 g/100 ml ved 25 ° C.
Løselighet i andre væsker
Blandbar med kortkjeden alifatisk, benzen, kloroform, oljeeter, fettoppløsningsmiddel, mange oljer og konsentrert saltsyre.
Løselig i aceton og veldig løselig i etanol. Det er også løselig i bensin, benzen og oljer.
Tetthet
0.714 mg/ml ved 20 ° C).
Damptetthet
2.55 (i forhold til luft tatt med tetthet 1).
Damptrykk
442 mm Hg ved 68 ° F. 538 mm Hg ved 25 ° C. 58,6 kPa ved 20 ° C.
Stabilitet
Det oksideres sakte ved virkningen av luft, fuktighet og lys med dannelse av peroksider.
Dannelsen av peroksider kan forekomme i eterbeholdere som har vært åpen og forblir i lagring i mer enn seks måneder. Peroksider kan utløse friksjon, påvirkning eller oppvarming.
Kontakten med: sink, halogener, ikke -metalliske oksihaluros, sterke oksidasjonsmidler, kromylklorid, treemine oljer, nitrater og metallklorider bør unngås.
Selvantenning
356 ° F (180 ° C).
Nedbrytning
Når han varmer, bryter han sammen, avgir en dekar og irriterende røyk.
Goo
0.2448 Poise ved 20 ° C.
Forbrenningsvarme
8.807 kcal/g.
Det kan tjene deg: Einstenio (er): Struktur, egenskaper, innhenting, brukFordampningsvarme
89.8 kalk/g a 30 ° C.
Overflatespenning
17.06 Dynas/cm ved 20 ° C.
Ioniseringspotensial
9.53 EV.
Lukt terskel
0.83 ppm (renhet er ikke gitt).
Brytningsindeks
1.355 til 15 ° C.
Skaffe etyleter
Etyleter fra etylalkohol kan oppnås, i nærvær av svovelsyre som katalysator. Svovelsyre i et vandig medium dissosierer som produserer hydroniumion, H3ENTEN+.
I motsatt prosess, det vil si hydrering av etylen i dampfase, kan etyleter dannes som et sikkerhetsprodukt i tillegg til etylalkohol. Faktisk produserer denne syntetiske ruten det meste av denne organiske forbindelsen.
Toksisitet av etyleter
Det kan produsere hud- og øyeirritasjoner. Hudkontakt kan gi reseksjon og sprekker. Eteren trenger vanligvis ikke gjennom huden, siden den raskt fordampes.
Irritasjonen av øynene forårsaket av eteren er vanligvis mild, og i tilfelle av alvorlig irritasjon er skaden generelt reversibel.
Svakingen gir narkotiske effekter og magesirritasjon. Alvorlig inntak kan forårsake nyreskade.
Etherinhalering kan forårsake irritasjon av nese og hals. Når det.
Høy eksponering kan forårsake tap av kunnskap og til og med død.
OSHA etablerer en arbeidseksponeringsgrense på 800 ppm i gjennomsnitt, i løpet av en 8 -timers skift.
Øyirritasjonsnivåer: 100 ppm (mennesker). Øyirritasjonsnivå: 1200 mg/m3 (400 ppm).
Bruk/applikasjoner av etyleter
Organisk løsningsmiddel
Det er et organisk løsningsmiddel som brukes til å oppløse brom, jod og andre halogener. De fleste lipider (fett), harpikser, rene gummier, noen alkaloider, gummi, parfymer, celluloseacetat, cellulosenitrat, hydrokarboner og fargestoffer.
Det kan tjene deg: Ingen metaller: Historie, egenskaper, grupper, bruksområderI tillegg brukes det i ekstraksjon av de aktive ingrediensene i dyr og planter vev, fordi det har mindre tetthet enn vannet og flyter på det, og etterlater de ønskede stoffene oppløst i eteren.
Generell anestesi
Det har blitt brukt som en generell bedøvelse siden 1840, og erstattet kloroform for å ha en terapeutisk fordel. Imidlertid er det et brennbart stoff, og finner derfor alvorlige vanskeligheter i bruken av kliniske områder.
I tillegg produserer det hos pasienter noen uønskede postoperative bivirkninger, for eksempel kvalme og oppkast.
Av disse grunner har bruken av eteren blitt kastet som en generell bedøvelse, og erstatter den med andre bedøvelsesmidler som Halotano.
Eter ånd
Eter blandet etanol.
Evaluering av blodsirkulasjon
Eteren har blitt brukt til å evaluere blodsirkulasjonen mellom den ene armen og lungene. Eteren blir injisert i en arm, tar blodet til høyre atrium, deretter til høyre ventrikkel og derfra til lungene.
Tiden som går fra injeksjonen av eteren, til fangst av lukten av eteren i den utåndte luften, er omtrent 4 til 6 s.
Undervisningslaboratorier
Eteren brukes i undervisningslaboratorier i mange eksperimenter. For eksempel i demonstrasjonen av Mendels genetikklover.
Eteren brukes til å nummen kjønnsfluene Drosophila og la de nødvendige korsene mellom dem fremheve genetikklovene.
Referanser
- Graham Solomons t.W., Craig f. Yngel. Organisk kjemi. Aminer. Wiley Plus.
- Ethher Ether. Gjenopprettet fra Britannica.com

