Tredje lov om termodynamikkformler, ligninger, eksempler
- 4270
- 624
- Daniel Skuterud
De Tredje lov om termodynamikk sier at entropien til et lukket termodynamisk system i likevekt har en tendens til å være minimal og konstant, når temperaturen nærmer seg 0 Kelvin.
Denne verdien av entropi vil være uavhengig av systemvariablene (trykket eller det påførte magnetfeltet, blant andre). Det som skjer er at når temperaturen er nærmere 0 k, blir prosessene i systemet stoppet og hvordan entropi er et mål på intern agitasjon, det øker nødvendigvis.
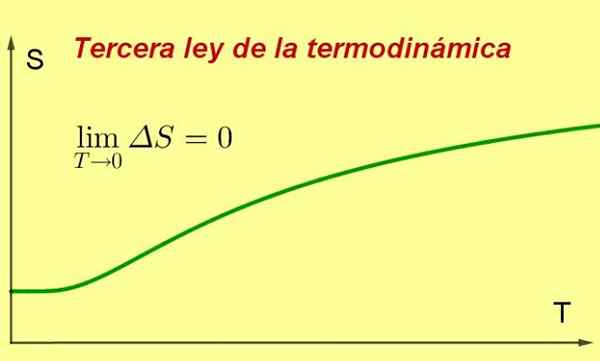
 Figur 1. Når temperaturen på et system nærmer seg det absolutte null, når dets entropi et minimum og konstant verdi. Kilde: Utarbeidet av F. Zapata ..
Figur 1. Når temperaturen på et system nærmer seg det absolutte null, når dets entropi et minimum og konstant verdi. Kilde: Utarbeidet av F. Zapata .. [TOC]
Tidligere konsepter
For å forstå omfanget av den tredje loven om termodynamikk, relevant for svært lave temperaturer, er det nødvendig å gjennomgå følgende konsepter:
Termodynamisk system
Det refererer vanligvis til en gass, en væske eller et fast stoff. Det som ikke er en del av systemet, kalles rundt. Det vanligste termodynamiske systemet er den ideelle gassen, som består av N -partikler (atomer) som bare samhandler gjennom elastiske kollisjoner.
Isolerte, lukkede eller åpne systemer
Isolerte systemer er ikke tillatt noen utveksling med miljøet. Lukkede systemer utveksler ikke noe med miljøet, men varme. Endelig kan åpne systemer utveksle både materie og varme med miljøet.
Makro -state og mikrostat
Makrostaten til et system er settet med verdier som har dets variabler: trykk, temperatur, volum, antall føflekker, entropi og indre energi. På den annen side er mikro -gjennomgangen -i tilfelle av en ideell gass gitt av posisjonen og momentumet til hver av N -partiklene som utgjør den, i et bestemt øyeblikk.
Mange mikrostater kan resultere i samme makrostat. I en gass ved romtemperatur er antall mulig mikrostat enormt, fordi antall partikler som utgjør det, de forskjellige posisjonene og de forskjellige energiene de kan ta i bruk er veldig stort.
Formler og ligninger
Entropi som vi sa, er en termodynamisk makroskopisk variabel som måler systemet med molekylær lidelse i systemet. Graden av forstyrrelse i et system er større i den grad antallet mulige mikrostater er større.
Dette konseptet er nødvendig for å formulere den tredje loven om termodynamikk i matematisk form. Det være seg entropien til systemet, da:

Entropi er en makroskopisk tilstandsvariabel som er direkte relatert til antall mulig mikrostat for et system, ved hjelp av følgende formel:
S = k ln (w)
I forrige ligning: S representerer entropi, W antall mulige mikrostater i systemet og k Det er Boltzmanns konstante (K = 1.38 x 10-23 J/k). Det vil si at entropien til et system er k ganger den naturlige logaritmen til antall mulige mikrostater.
Beregning av absolutt entropi av et stoff
Det er mulig å definere den absolutte entropien til et rent stoff basert på definisjonen av variasjonen av entropi:

Δq = n . cp .Dt
Her er CP den spesifikke molare varmen og ikke antall føflekker. Molar spesifikk varmeavhengighet med temperatur er et eksperimentelt oppnådd faktum og kjent for mange rene stoffer.
Kan tjene deg: Solsystem: planeter, egenskaper, opprinnelse, evolusjonI henhold til den tredje loven i rene stoffer:
=0)
=\int_0^T\frac\overlinec_pdTT)
applikasjoner
I dagliglivet har den tredje loven om termodynamikk få applikasjoner, ganske i strid med den første og andre loven. Det er fordi det er et prinsipp som refererer til hva som skjer i et system når det nærmer seg den absolutte 0, en rangering av sjeldne temperaturer.
Nå, nå den absolutte eller −273,15 ° C er faktisk umulig (se eksempel 1 senere) Imidlertid brukes den tredje loven når du studerer responsen til materialene ved veldig lave temperaturer.
Takket være dette har viktige fremskritt i kondensert sak dukket opp, for eksempel:
-Overfluiditet (se eksempel 2 senere)
-Superledelse
-Laserkjølingsteknikker
-Bose-Einstein kondensat
-Fermi overflødige gasser.
 Figur 2. Overflødig flytende helium. Kilde: Wikimedia Commons.
Figur 2. Overflødig flytende helium. Kilde: Wikimedia Commons. Ved ekstremt lave temperaturer tillater nedstigningen av entropi fremveksten av interessante kvantefenomener. La oss derfor se hva som skjer med entropien til et veldig lavt temperatursystem.
Entropi av et lavtemperatursystem
Når du har et perfekt krystallinsk stoff, er den minste entropien nøyaktig null, siden det er et veldig ryddig. I temperaturer nær absolutt 0 er materien i kondensert tilstand (væske eller faststoff) og glassvibrasjoner er minimale.
Noen forfattere vurderer en alternativ uttalelse av den tredje loven om termodynamikk Følgende:
"Hvis materie kondenserer en perfekt krystall, når temperaturen har en tendens til absolutt null, har entropi nøyaktig til null".
La oss punktualisere noen aspekter av forrige uttalelse:
- En perfekt krystall er en der hvert molekyl er identisk og hvor molekylstrukturen gjentas identisk i sin helhet.
- Ettersom temperaturen har en tendens til absolutt null, reduseres atomvibrasjonen nesten fullstendig.
Da danner glasset en mulig mulig konfigurasjon eller mikrooppstilling, det vil si W = 1, Og derfor er entropi lik null:
S = k ln (1) = 0
Men ikke så lenge et materiale avkjølt nær de absolutte nullene danner en krystall, mye mindre denne krystallen er perfekt. Dette skjer bare hvis kjøleprosessen er veldig treg og reversibel.
Ellers vil faktorer som urenheter som er til stede i glasset muliggjøre eksistensen av andre mikrostater. Derfor vil w> 1 og entropi være større enn 0.
Rest entropi
Hvis kjøleprosessen er brått, går systemet i løpet av det samme gjennom en rekke ikke -balansestater, noe som fører til materialet å vise. I dette tilfellet er det ingen krystallinsk og ordnet struktur, men et amorf fast stoff, hvis struktur ligner på en væske.
I så fall er den minste entropiverdien i nærheten av absolutt null ikke null, siden antallet mikrostater er mye større enn 1. Forskjellen mellom denne entropien og nulltropien til den perfekte krystallinske tilstanden er kjent som Rest entropi.
Forklaringen er at systemet under en viss terskeltemperatur har ingen annen mulighet enn å okkupere.
Det kan tjene deg: Første lov om termodynamikk: Formler, ligninger, eksemplerDe vil være ansvarlige for å opprettholde konstant entropi, selv om temperaturen fortsetter å gå ned mot absolutt null.
Eksempler
Eksempel 1: Den absolutte null og ubestemmelse av Heisenberg
Heisenberg -ubestemmelsesprinsippet fastslår at usikkerheten i posisjonen og momentumet til en partikkel, for eksempel i atomene i et krystallinsk nettverk, ikke er uavhengig av den andre, men følg følgende ulikhet:
Δx ⋅ Δp ≥ h
Hvor h er Plancks konstant. Det vil si at usikkerheten i posisjonen multiplisert med usikkerhet i momentumet (masse per hastighet) er større enn eller lik Planck -konstanten, hvis verdi er veldig liten, men ikke null: H = 6.63 x 10-3. 4 J · s.
Og hva har usikkerhetsprinsippet å gjøre med den tredje loven om termodynamikk? Hvis plasseringen av atomene i det krystallinske nettverket er fast og presis (Δx = 0) Da kan hastigheten på disse atomene ta enhver verdi mellom 0 og uendelig. Dette motsies av det faktum at i absolutt null, opphører hver bevegelse av termisk omrøring.
Gjensidig, hvis vi starter at ved absolutt null av temperaturen, opphører all omrøring og momentumet til hvert atom i nettverket er nøyaktig null (ΔP = 0), da usikkerhetsprinsippet i Heisenberg ville innebære at ubestemmelsen i posisjonene til hvert atom ville være uendelig, det vil si at de kan være i hvilken som helst posisjon.
Som en konsekvens av den forrige uttalelsen, vil antallet mikrostater ha en tendens til uendelig, og entropi vil også ta ubestemmelig verdi.
Eksempel 2: Overfluiditet og det rare tilfellet med helium-4
I overflødighet, som oppstår ved svært lave temperaturer, mister materien indre friksjon mellom molekylene, kalt goo. I dette tilfellet kan væsken sirkulere uten friksjon for alltid, men problemet er ved de temperaturene nesten ingenting er væske bortsett fra helium.
Helium og helium 4 (dens mest tallrike isotop) utgjør en unik sak, siden helium forblir væske ved atmosfæretrykket og ved temperaturer nær absolutt null, forblir væske.
Når helium-4 sendes inn ved en temperatur under 2.2 k ved atmosfæretrykk blir en overflødig. Denne oppdagelsen skjedde i 1911 i Leyden av den nederlandske fysikeren Heike Kamerlingh Onnes (1853-1926).
 Figur 3. Dutch Physicist Heike Kamerlingh Onnes (1853-1926). Kilde: Wikimedia Commons.
Figur 3. Dutch Physicist Heike Kamerlingh Onnes (1853-1926). Kilde: Wikimedia Commons. Helio-4 atom er en Bosón. Bosoner, i motsetning til fermioner, er partikler som kan okkupere alle samme kvantetilstand. Derfor oppfyller bosoner ikke Paulis eksklusjonsprinsipp.
Deretter alle helium-4-atomer ved temperaturer under 2.2 k okkuperer den samme kvantetilstanden, og det er derfor ikke annet enn en mulig mikrostat, noe som antyder at overflødig helium-4 har s = 0.
Løste øvelser
- Oppgave 1
Vurder en enkel sak bestående av et system som bare er dannet av tre partikler som har tre energinivåer. For dette enkle systemet:
a) Bestem antall mikrostat som er mulig for tre temperaturområder:
-høy
-Halv
-Lav
b) Bestem gjennom Boltzmann -ligningsentropien i de forskjellige temperaturområdene.
c) Diskuter resultatene og forklar om du vil motsi den tredje loven om termodynamikk eller ikke.
Løsning på
På en molekylær og atomskala er energiene som et system kan ta i bruk, noe som betyr at bare visse diskrete verdier kan ta. I tillegg, når temperaturene er så lave, har partiklene som utgjør systemet bare muligheten til å okkupere mindre energinivå.
Det kan tjene deg: Magnetisk induksjon: Formler, hvordan det beregnes og eksemplerHøy temperatur
Hvis systemet har en relativt høy temperatur, har partiklene nok energi til å okkupere tilgjengelige nivåer, noe som gir opphav til 10 mulige mikrostater, som vises i følgende figur:
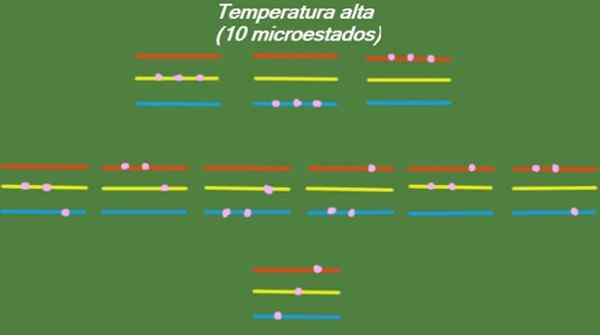 Figur 4. Mulige stater ved høy temperatur for året løst 1. Kilde: Utarbeidet av F. Zapata.
Figur 4. Mulige stater ved høy temperatur for året løst 1. Kilde: Utarbeidet av F. Zapata. Medium temperatur
I tilfelle at systemet har en mellomtemperatur, har ikke partiklene som utgjør det opp nok energi til å okkupere det høyeste energinivået. De mulige mikrostatene er illustrert i figuren:
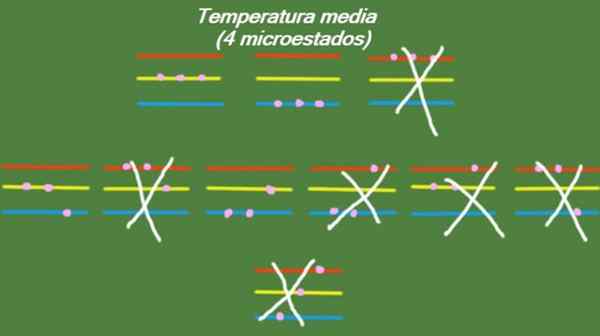 Figur 5. Mikro -state ved gjennomsnittstemperatur for det løste treningssystemet 1. Kilde: Utarbeidet av F. Zapata.
Figur 5. Mikro -state ved gjennomsnittstemperatur for det løste treningssystemet 1. Kilde: Utarbeidet av F. Zapata. Lav temperatur
Hvis temperaturen fortsetter å stige ned i våre idealiserte tre partikler og tre energinivåer, vil partiklene ha så liten energi at de bare kan okkupere det laveste nivået. I dette tilfellet er det bare en mulig mikrostat, som det kan sees i figur 6:
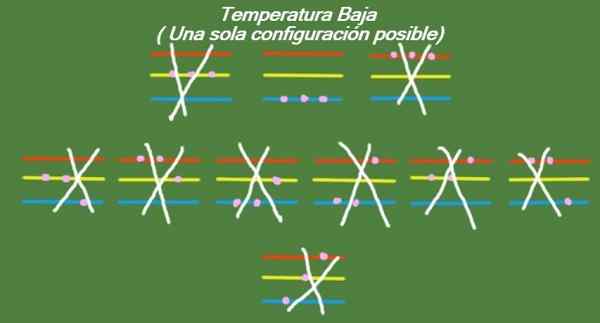 Figur 6. Ved lav temperatur er det en mulig konfigurasjon (egen utdyping)
Figur 6. Ved lav temperatur er det en mulig konfigurasjon (egen utdyping) Løsning b
Allerede kjent antall mikrostater i hvert temperaturområde, kan vi allerede bruke Boltzmann -ligningen gitt tidligere for å finne entropi i hvert tilfelle.
S = k ln (10) = 2.30 x k = 3.18 x 10-23 J/k (Høy temperatur)
S = k ln (4) = 1.38 x k = 1.92 x 10-23 J/k (Middels temperatur)
Og endelig:
S = k ln (1) = 0 (Lav temperatur)
Løsning c
For det første merker vi at entropi avtar etter hvert som temperaturen går ned, som forventet. Men for de laveste temperaturverdiene er en terskelverdi nådd, som grunnstatusen til systemet er nådd.
Selv om temperaturen er så nær Absolute null som mulig, er det ingen mindre tilstander tilgjengelig. Deretter opprettholder entropi sin konstante minimumsverdi, som i vårt eksempel er s = 0.
Denne øvelsen illustrerer, på nivå med mikrostatene til et system, grunnen til at den tredje loven for termodynamikk er oppfylt.
- Oppgave 2
Årsak hvis neste uttalelse er sann eller usant:
"Entropien til et system ved den absolutte temperaturen null er nøyaktig null".
Rettferdiggjøre svaret og beskriv noen eksempler.
Løsning
Svaret er: falsk.
Først av alt kan den absolutte temperaturen ikke oppnås fordi prinsippet om usikkerhet om Heisenberg og den tredje loven om termodynamikk ville bli krenket.
Det er veldig viktig å observere at det i den tredje loven ikke blir sagt hva som skjer i det absolutte 0, men når temperaturen er uendelig nær den absolutte 0. Forskjellen er subtil, men betydelig.
Den tredje loven bekrefter ikke at når temperaturen tar en verdi vilkårlig nær absolutt null, har entropi en tendens til null. Dette ville bare skje i det tidligere analyserte tilfellet: den perfekte krystallen, som er en idealisering.
Mange mikroskopiske skala -systemer, det vil si i kvanteskala, har sitt energibase -nivå degenerere, Hva betyr eksistensen av flere konfigurasjoner på det laveste energinivået.
Ovennevnte betyr at i disse systemet ville entropi aldri være nøyaktig null. Entropi ville heller ikke være nøyaktig null i systemer som er forglaset når temperaturen har en tendens til absolutt null. I dette tilfellet Rest entropi Før sett.
Det er fordi molekylene deres var "fast" før de okkuperer de laveste nivåene av energi som er tilgjengelig, noe som betydelig øker antallet mulige mikrostat, noe som gjør det umulig at entropi er nøyaktig null.
Referanser
- Cengel, og. 2012. Termodynamikk. 7. utgave. McGraw Hill. 347.
- Jet fremdriftslaboratorium. Det kuleste stedet i universet. Gjenopprettet fra: Coldatomlab.Jpl.gryte.Gov.
- González, a. Entropi og spontanitet. Gjenopprettet fra: Geocities.Ws
- Quora. Hva er den praktiske bruken av tredje lov av termodynamikk?. Gjenopprettet fra: Quora.com
- Generell kjemi. Tredje prinsipp for termodynamikk. Gjenopprettet fra: Korint.PUCP.Edu.PE
- Tredje lov om termodynamikk. Gjenopprettet fra: YouTube.com
- Wikipedia. Entropi rest. Hentet fra: i.Wikipedia.com
- Wikipedia. Tredje lov om termodynamikk. Hentet fra: i.Wikipedia.com
- « Hvilke ulykker forekommer hyppigst hos små barn og voksne?
- Tricloroeddiksyrestruktur, egenskaper, syntese, bruksområder, effekter »

