Farging av sporer
- 1146
- 223
- Theodor Anders Hopland
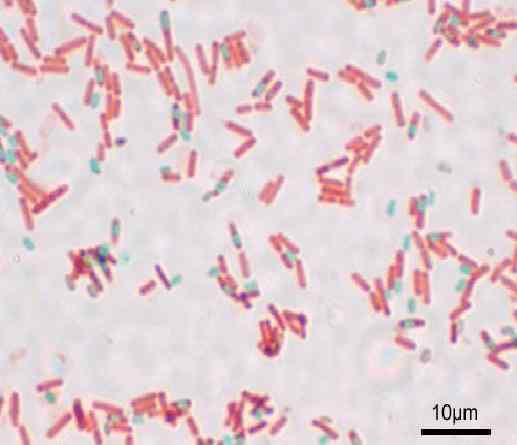
 Farging av sporer av Shaeffer-Fulton eller Wirtz-Conklin-metoden. Kilde: Y også (Original Uploader) [GFDL (http: // www.gnu.Org/copyleft/fdl.HTML) eller CC-BE-SA-3.0, Wikimedia Commons
Farging av sporer av Shaeffer-Fulton eller Wirtz-Conklin-metoden. Kilde: Y også (Original Uploader) [GFDL (http: // www.gnu.Org/copyleft/fdl.HTML) eller CC-BE-SA-3.0, Wikimedia Commons Hva er farging av sporer?
De Farging av sporer Det er metodikken som brukes til å fargelegge resistensstrukturene som danner noen bakterielle slekter når de er under ugunstige forhold. Det tjener til å identifisere bakterier.
Det er mange sjangre som danner sporer, men de viktigste er Bacillus og Clostridium. Disse sjangrene anses som mer relevante fordi de har patogene arter for mennesket.
Hver bacillus kan gi opphav til en spore. På tidspunktet for farging av preparatet, kan sporen finnes inne i Bacillus (endospora) eller utenfor denne (Exospora). Med konvensjonelle fargeleggsteknikker for bakterier - som farging av gram - sporer er fargeløse.
For tiden er det flere fargemetodologier som er i stand til å krysse den tykke strukturen til sporen for å farge den. Disse metodikkene er veldig varierte, og Dorners teknikk, Möellers farging og Shaeffer-Fulton-metodikk, også kjent som Wirtz-Conklin kan nevnes.
Av alle nevnte teknikker, er Shaeffer-Fultons metodikk den mest brukte i rutinemessige laboratorier. Skylder navnet til to mikrobiologer som opprettet fargen i 1930: Alicia Shaeffer og MacDonald Fulton. Noen ganger kalles imidlertid teknikken Wirtz-Conklin til ære for to 1900-bakteriologer.
Basis
Sporene er ikke farget med konvensjonelle fargestoffer fordi de har en veldig tykk vegg. Sporerens komplekse sammensetning forhindrer inntreden av de fleste fargestoffer.
Hvis spore av utvendig studeres innover, blir følgende lag observert: For det første er det eksosporium, som er det fineste og mest ytre laget dannet av glykoproteiner.
Så kommer kutikula, som gir motstand mot høye temperaturer, etterfulgt av cortex sammensatt av peptidoglykan. Deretter er det basen til basen som beskytter protoplasten.
Sporen er en dehydrert struktur som inneholder 15% kalsium- og dipycolinsyre. Derfor er de fleste sporer fargeleggsteknikker basert på varmeapplikasjon slik at fargestoffet kan trenge gjennom den tykke strukturen.
Kan tjene deg: laktogenese: Kjennetegn og stadierNår sporen er farget, kan den ikke eliminere fargestoffet. I Shaeffer-Fulton-teknikken kommer Malakites grønne inn i vegetative celler, og ved å bruke varme trenger endospora ved å bruke varmen.
Når du vasker med vann, fjernes fargestoffet fra den vegetative cellen. Dette skjer fordi Malachites grønne fargestoff er litt grunnleggende, så den vegetative cellen binder svakt.
I stedet kan du ikke komme ut av sporen, og til slutt blir bacillusen med Safranine ansatt. Dette grunnlaget er gyldig for resten av teknikkene, der noe lignende skjer.
Sporer fargeleggsteknikker
For å utføre farging av sporer må du ha en ren avling av den mistenkelige belastningen du vil studere.
Avlingen blir utsatt for ekstreme temperaturer i 24 timer for å stimulere mikroorganismen til sporulær. For dette kan avlingen plasseres i en 44 ° C eller i kjøleskap (8 ° C) i 24 eller 48 timer.
Hvis du drar for lenge ved de nevnte temperaturene, vil bare eksospaler bli observert, siden alle endosporer vil ha forlatt Bacillus.
Kulminert tid, bør noen få dråper steril fysiologisk løsning på et rent lysbilde plasseres. Da tas en liten del av avlingen og en utvidet bot.
Deretter er det tillatt å tørke, den er festet i varmen og fargestoffet med noen av teknikkene som er forklart nedenfor:
Dorner -teknikk
- Forbered i et testrør En konsentrert suspensjon av mikroorganismen sporulert i destillert vann og tilsett et like volum av Fenicada Fuchsina av Kinyoun filtrert.
- Plasser røret i et bad med kokende vann i mellom 5 og 10 minutter.
- På en ren lysbilde blandet en dråpe av den forrige suspensjonen med en dråpe vandig nigrosinoppløsning ved 10%, kokt og filtrert.
- Utvide og tørr med myk varme.
- Undersøk med 100x mål (fordypning).
Sporene er farget røde og bakterieceller virker nesten fargeløse mot en mørkegrå bakgrunn.
Kan tjene deg: helmintologi: opprinnelse, hvilke studier, eksempel på forskningModifisert Dorner -teknikk
- En utvidet en av en suspensjon av den sporulerte mikroorganismen er laget på et lysbilde og fikset for å varme.
- Prøven er dekket med en filterpapirstripe som Fenicada Fuchsin tilsettes. Fargestoffet varmes opp 5 til 7 minutter med flammen på bunsen lettere til dampavløsning er generert. Så blir papiret trukket tilbake.
- Forberedelsen med vann vaskes og tørker deretter med absorberende papir.
- Smøret er dekket med en tynn film med 10%nigrosin, ved å bruke et andre lysbilde for å utvide nigrosin eller en nål.
Fargen tatt av sporer og bakterier er lik den som er beskrevet i forrige teknikk.
Shaeffer-Fulton eller Wirtz-Conklin-teknikken
- Lag en utvidet bot med en suspensjon av sporulert mikroorganisme på et lysbilde og fikse varmen.
- Dekk lysbildet med vandig grønn malakittløsning ved 5% (et filterpapir kan plasseres på arket).
- Varm på flammen til Bunsens lighter til den forårsaker dampavløsning og fjerner flammen. Gjenta operasjonen 6 til 10 minutter. Hvis den under prosedyren den malakittgrønne løsningen fordamper, kan mer legges til.
- Fjern filterpapiret (hvis plassert) og vask med vann.
- Dekk lysbildet med 0,5% vandig safranin i 30 sekunder (noen varianter av teknikken bruker 0,1% vandig safranin og la den ligge i 3 minutter).
Med denne teknikken blir sporer presentert grønt og de røde bacilliene.
Det har ulempen at endosporene til unge avlinger ikke er farget godt, siden de ser ekstremt klare eller fargeløse. For å unngå dette anbefales det å bruke 48 -timers inkubasjonsavlinger.
Möeller -teknikk
- Dekk smøret med kloroform i 2 minutter.
- Kast kloroform.
- Dekk med 5% kromsyre i 5 minutter.
- Vask med destillert vann.
- Arket med fuchsin-fenikada karbo er dekket og utsatt for flammen på bunsen lettere til utslippet av damper, deretter fjernes det fra flammen noen få øyeblikk. Operasjonen gjentas til 10 minutter.
- Vask med vann.
- Bruk surgjort etanol (hydroklorisk alkohol) til misfarging. Det er igjen i 20 eller 30 sekunder.
- Vask med destillert vann.
- Leie som dekker arket med metylenblått i 5 minutter.
- Vask med destillert vann.
- Det har lov til å tørke og ta prøven til mikroskopet.
Sporene ser røde ut og de blå bacilliene. Det er viktig å ikke strebe etter damper, ettersom de er giftige og langsiktige de kan være kreftfremkallende.
Möeller -teknikk modifisert uten varme
I 2007 skapte Hayama og hans samarbeidspartnere en modifisering av Möellers teknikk. De eliminerte fargelegging av fargestoffet og erstattet det med tilsetning av 2 dråper av det overflateaktive tergitol 7 for hver 10 ml fuchsin-fenikert karbolløsning. De samme resultatene ble oppnådd.
applikasjoner
Farge på sporer gir veldig verdifull og nyttig informasjon for identifisering av patogenet, siden tilstedeværelsen av det samme, dens form, plassering i bacillus og evnen til å deformere den vegetative cellen eller ikke, er data som kan lede arten på arten som er involvert i et visst kjønn.
I denne sammenhengen er det verdt å si at sporer kan være runde eller ovale, de kan være plassert i sentrum eller også i en palacentral, underterminal eller terminalposisjon.
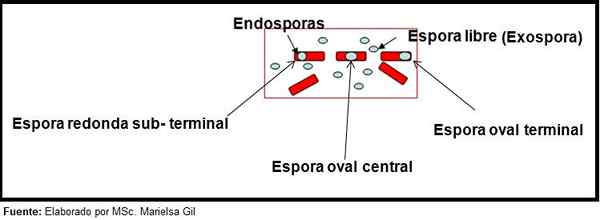 Skjema for form og plassering av endosporer og eksospore
Skjema for form og plassering av endosporer og eksospore Eksempler
- Clostridium difficile Den danner en oval spore i en terminalposisjon som deformerer bacillus.
- Sporet av Clostridium Tertium Den er oval, deformerer ikke bacillusen og ligger på terminalnivå.
- Endospora av Clostridium Tetani Det er terminal og deformerer bacillusen, og gir utseendet til en trommelpinne.
- Sporer av Clostridium botulinum, C. histolyticum, C. Novy og C. Septicum De er runde eller ovale, underjordiske og deformerer Bacillus.
- Endospora av Clostridium Sordelli Det ligger i den sentrale posisjonen, med en liten deformasjon.
Referanser
- Moeller flekk. Innhentet fra.Wikipedia.org.
- Endospora. Gjenopprettet fra Es.Wikipedia.org.
- Forbes, f., SAHM, d., Weissfeld, a. Bailey & Scott mikrobiologisk diagnose. Pan -American redaksjon S.TIL.

