Wright -farging
- 1595
- 205
- Prof. Theodor Gran
 Ulike perifer blodsmess farget med Wright -farging. TIL. Akutt leukemi b. Plasmodium vivax innenfor erytrocyten. C. Plasmodium falciparum, macrogametocito. D. Lymfocytt
Ulike perifer blodsmess farget med Wright -farging. TIL. Akutt leukemi b. Plasmodium vivax innenfor erytrocyten. C. Plasmodium falciparum, macrogametocito. D. Lymfocytt Hva er Wrights farging?
De Wright -farging Det er en fargeleggingsteknikk laget av den amerikanske patologen James Homer Wright i 1902, basert på Romanowskys farging, for bedre å skille forskjellige typer blodceller.
Denne fargen er polykromatisk, noe som betyr at den genererer flere farger avhengig av strukturen som absorberer fargestoffet. Denne fargeleggsteknikken har blitt mye brukt til å utføre differensielle hvite blodlegemer og studere morfologien til røde blodlegemer, blodplater og leukocytter i perifert blod og benmarg.
Bruksområdet er veldig viktig, siden abnormiteter kan sees i de forskjellige cellelinjene i blodet, noe som letter diagnosen sykdommer som leukemi eller bakterie- eller parasittinfeksjoner.
Kanskje dette er de vanligste applikasjonene der denne teknikken brukes, men de er ikke de eneste. Det er også nyttig i andre andre prøver enn blod og benmarg, for eksempel prøver av nasal sekresjon, fekal slim, sputum, hud, blant andre.
Grunnlaget for Wrights farging
Wrights farging ble født fra Romanowsky -flekken.
Blandingen av fargestoffer som brukes i Wright -farging forårsaker effekten kjent som Romanowsky, det vil si at den gir en vakker lilla fargelegging til leukocytter kjerner og neutrofile granuler, mens røde blodlegemer er farget rosa.
Komponentene som er ansvarlige for å gi utvalget av typiske farger på Wrights farging er Blue B og Eosina og. Den observerte effekten vil avhenge av fargestoffens kobling til de kjemiske strukturene og interaksjonene mellom blå B og eosin og.
Syrestrukturer, for eksempel nukleinsyrer, nukleære proteiner og umoden reaktiv cytoplasma av noen typer celler, sett blå B (grunnleggende fargelegging).
Mens grunnleggende strukturer, som hemoglobin, satte granulatene til de segmenterte eosinofiler, blant andre cellestrukturer, eosin og (syrefarging).
Fargestillingsresultatet kan påvirkes av forskjellige faktorer, for eksempel pH i Wright -fargestoffet, demping og vaskeoppløsning, samt farging og fikseringstid.
Derfor er hvert trinn i utarbeidelsen av reagensene avgjørende og må gjøres å ta vare på hver eneste detalj.
Materialer
Wright Dye. For 100 ml er det nødvendig:
Veie 0.3 gr av wright fargestoff, måle 97 ml metanol og 3 ml glyserol.
Forberedelse
På en mørtel plasserer den tunge mengden av Wrights fargestoff og inkorporerer gradvis glyserol til støvet er helt oppløst.
Deretter tilsettes metanol, blandet og helles i en ravflaske.
Før bruk må løsningen med myke bevegelser og filter omrøres.
Kan tjene deg: Retningsvalg: Hva er definisjon, eksemplerBuffret bufferløsning
I en liter destillert vann tilsettes 3,76 g desodiumhydrofosfat (Na2Hpo4 2H20) pluss 2.1 GR av dihydrogenous kaliumfosfat (KH2Po4).
Bland veldig godt til du løser opp alle reagensene som er innlemmet. Juster pH til 7.2. Hell i en glasskrukke og hold deg ved romtemperatur.
Ytterligere materialer som trengs for å utføre farge
I tillegg er andre materialer pålagt å utføre fargeleggsteknikken, dette er: Porta -objekter eller dekker objekter, fargebro, bånd med vann eller buffer for vasking, stoppeklokke for å ta fargetider og litt tørkemateriale (absorberende papir, gasbind eller bomull ).
Wright -fargekomponenter
Metanol
Alkohol (metanol) fungerer som en fixer av blodutstrykning til lysbildet.
I utgangspunktet er det en reduserende reaktiv, dehydrator og coagulant fixativ. Derfor er deres funksjon å koagulere proteiner og gjøre dem uoppløselige, men uten å bli denaturert.
Metanol er det mest brukte reagenset for å fikse smør i alle laboratorier, siden det gir bedre resultater enn de som er oppnådd med etanol. Den ideelle konsentrasjonen er 99%.
Støtdemperen
Støtdemperen (buffret løsning), har funksjonen som justering eller vedlikehold.
Passering av å fikse med metanol dehydrater celler og støtdemper hjelper med å rehydrere dem.
Eosina (y)
Eosina har en tilhørighet til grunnleggende komponenter fordi det er et surt fargestoff. To typer eosin er kjent veldig lik hverandre, så mye at enten kan brukes, og oppnå samme resultat.
Den ene kalles eosin og, gul eosin eller tetrabromofluorescein, og den andre, eosin b, blåaktig eritrosin eller dibromodyitrofluorescein. Imidlertid Eosin og er den som brukes hyppigst.
Den viktigste egenskapen til dette fargestoffet er dens negative polaritet, dette gjør det tiltrukket av cellulære strukturer med positiv belastning.
Metylenblått
Er det grunnleggende fargestoffet. Hovedegenskapen er Metacromia, det vil si at ikke alle strukturer vil være farget av samme farge, det vil avhenge av den kjemiske sammensetningen av strukturene som er fargelegging.
Noen vil bli lys eller mørkeblå, og andre av mørk lilla eller blek syrin.
Teknikk
- Lag den utvidede prøven slik at det er en tynn film, enten det er på et lysbilde eller dekker.
- La luften tørke i omtrent 2 timer.
- Plasser den tørre lukten på fargebroen eller fargingsbøtten med den utvidede prøven opp.
- Dekk arket med Wright Drop by Gota for å dekke hele overflaten. La loven være i 5-8 minutter.
- Fargestoffet må dekke lysbildet helt, uten å søle gjennom kantene. Hvis det i løpet av fargelegget begynner å fordampe, må ytterligere dråper plasseres.
- Legg deretter til en like stor mengde støtdemper, blåser litt til den karakteristiske metalliske lysstyrken vises. Temme 10 til 15 minutter.
- Vask med vann fra springen, plasser den myke jet til arket ser rosa ut.
- Med en gasbind impregnert med alkohol eliminerte fargeleggingen på baksiden av lysbildet.
- La smøret tørke før du plasserer nedsenkningsoljen for å visualisere den i mikroskopet.
Bruker/applikasjoner av Wright -farging
Hematologi
Det er ideelt for farging av perifert blodrubo.
På grunn av de kjemiske egenskapene til denne kombinasjonen av fargestoffer, kan cellestrukturer lett gjenkjennes, og kunne skille de forskjellige typer celler som er til stede.
Rennende nese
Denne teknikken er veldig nyttig for å identifisere nasale sekresjonsceller (epitelceller, segmenterte eosinofiler, polymorfonukleær) i diagnosen allergisk rhinitt.
parasitologi
I denne forstand har det vært nyttig for studiet av Leishmania sp Innenfor histiocyttene til det subkutane cellevevet i hudsår. Det brukes også til å identifisere leukocytter i avføringsprøve (fekal leukogram).
I dette tilfellet er det av interesse for legen å vite om leukocytosen som er til stede i avføringen er av polymorfonukleær eller mononukleær. Dette funnet i det fekale leukogrammet vil lede om det er en bakteriell eller virusinfeksjon henholdsvis.
På den annen side kan parasittene som sirkulerer i blodet være inne i erytrocytten eller fri i plasmaet. De etterspurte parasittene er Plasmodium spp, Trypanosoma cruzii og filarier, og i veterinær er nyttig i jakten på Theilery Equ og Babesia Caballi, Årsaksmidler av baby, spesielt hos hester.
Fargen på Wright, og også den fra Giemsa, tillater å skille hemoparasitter fra normale cellulære komponenter. For dette kan to typer utvidede brukes:
Fin utvidet
Blod utvides som en tynn film på et lysbilde. Wright -farging, avslører egenskapene til kjernen og cytoplasma.
Tykk dråpe
Denne metodikken brukes til å undersøke tilstedeværelsen av parasitter i en større mengde blod.
For dette plasseres en stor bloddråpe på et lysbilde. Når du er der, må du defibrine, lage større og større sirkler fra midten ut, bruke kanten av et annet lysbilde.
Til slutt, for å observere parasittene i den tykke lukten, må erytrocytter være oppført med vann.
Luftveisinfeksjoner
På luftveiene er denne teknikken også nyttig, fordi cellene som er til stede i sputumprøver, bronkial eller bronkalveolar vasking er viktig for å etablere diagnosen.
Her kan du skille polymorfonukleære celler og mononukleære celler.
Bakteriologi
Bruken av denne teknikken i bakteriologi er begrenset, fordi det ikke er bra å farge bakterier. Derfor, for farging, brukes andre spesialiserte fargeleggsteknikker.
Imidlertid har den blitt brukt til å søke på epitelceller med inkluderingslegemer Chlamydia trachomatis I utstryking av urinrør eller endocervical slimhinne, selv om det må gjenkjennes at det ikke er den beste metoden.
Det kan tjene deg: hemokianinerDet er også mulig å observere, blant røde blodlegemer, spiralbakterier, som for eksempel Borrelia Burgdorferi Hos infiserte pasienter, så vel som morula eller inkludering av inkludering av Ehrlichia sp I cytoplasma av lymfocytter, monocytter eller nøytrofiler i blodutstrytelse.
Mykologi
Han Histoplasma capsulatum Det er en ofte diagnostisert patogen sopp ved mikroskopisk observasjon av forskjellige vevsprøver, farging med Wright -farging.
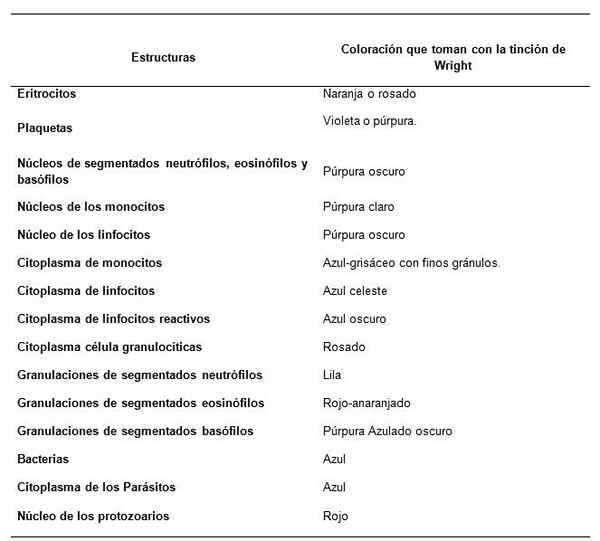
Hvordan observeres blodprøvestrukturene med Wrights farging?
 Anbefalinger for tincion av Sanguineous Srols for hemogramlesing. Kilde: Retamales E, Mazo V. Public Health Institute, regjeringen i Chile
Anbefalinger for tincion av Sanguineous Srols for hemogramlesing. Kilde: Retamales E, Mazo V. Public Health Institute, regjeringen i Chile Anbefalinger for god farging
- Utvidelsene av blodprøver må tørke spontant. Smørene skal være så tynne som mulig for å oppnå en bedre fiksering av fargestoffet og unngå overlapping.
- For farging av høy kvalitet er det tilrådelig. På den annen side er den ideelle prøven kapillærblod, uten antikoagulant.
- Imidlertid, hvis venøst blod brukes, bør det brukes som en EDTA og ikke -heparin antikoagulant, siden sistnevnte kan deformere cellulære strukturer.
- For å unngå forverring av det forberedte fargestoffet, må det lagres på tørre steder.
- Under vaskeprosessen anbefales bruk av vann justert til nøytral pH.
- Det anbefales å teste fargestoffmetodene som brukes i laboratoriet fra tid til annen.
Dette gjøres fargingsprøver eller utvidede mønstre, som kvalitetskontroll. Dette trinnet er viktig, siden det er sikret at farging er riktig forberedt og fargestidene er godt standardisert.
Hvis mønsterarket er dårlig farget, er det problemer som må løses.
Vanlige feil i Wrights farge
Veldig blek farging
De veldig bleke utstrykene skyldes vanligvis veldig kort tid med farging eller en veldig overdrevet vask. Det korrigeres ved å forlenge kontakttiden med fargestoffet eller synkende vasketid.
Klokker av fargestoffet
Tilstedeværelsen av fargelegging utfeller i lukten kan ha flere årsaker. De hyppigste er: bruk av det ikke -filtrerte fargestoffet, fargestoff på ujevne fargebroer, bruk skitne ark med støv eller fett, ikke gjør en god vask når fargingen er fullført.
Gni med ekstremt rødlig eller blå farge
Støtdemperen er ansvarlig for pH i fargestoffet. Farger med pH under den angitte (syre) vil føre til å oppnå veldig rødlig lukter.
Hvis fargestoffet er over (alkalisk) vil oppnå en ekstremt blåaktig smør.
Lagringsmodus
Reagenset må lagres ved romtemperatur.
Referanser
- López-Jácome, l., Hernández-Durán, m., Colín-Castro, ca., Ortega-Peña, s., Cerón-González, g., Franco-Cendejas, f. (2014). Grunnleggende farging i mikrobiologilaboratoriet. Funksjonshemming forskning.
- Calderón, a., Cardona, J., Vergara, eller. (2013). Babesia spp frekvens. I hester av Montería, Córdoba (Colombia). Rev. Udcaactual Disculg. forsker.
- Retamales, e., Mazo, v. Public Health Institute of Chile. Anbefalinger for tincion av Sanguineous Srols for hemogramlesing.

