Ziehl-Neelsen-farging
- 688
- 98
- Anders Mathisen
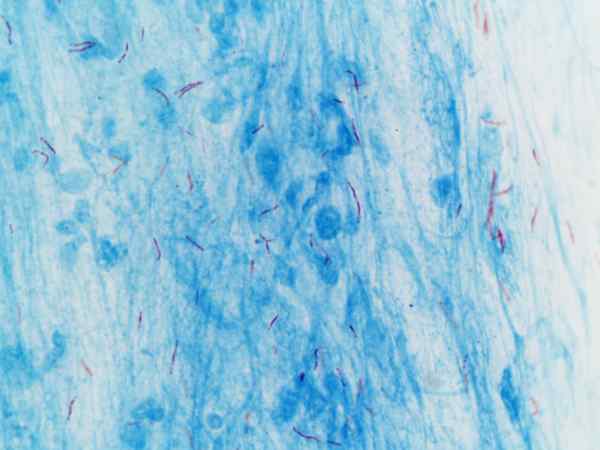
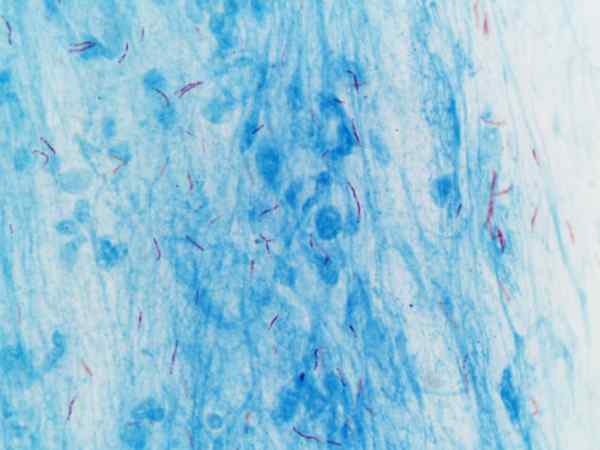 Mycobacterium tuberculosis visualisert med farging av Ziehl-Neelsen
Mycobacterium tuberculosis visualisert med farging av Ziehl-Neelsen Hva er Ziehl-Neelsens farging?
De Ziehl-Neelsen-farging I en fargeleggingsteknikk for å identifisere resistente alkohol-syre mikroorganismer (AAR). Navnet på denne mikrobiologiprosedyren refererer til forfatterne: Bakteriologen Franz Ziehl og patologen Friedrich Neelsen.
Denne teknikken er en differensiell fargetype, som innebærer bruk av forskjellige fargestoffer for å skape kontrast mellom strukturene som er ønsket å observere, differensiere og deretter identifisere. Ziehl-Neelsens farging tjener til å identifisere visse typer mikroorganismer.
Noen av disse mikroorganismene er Mycobacteria (for eksempel, Mycobacterium tuberculosis), Nocardias (for eksempel, Nocardia sp.) og noen encellede parasitter (for eksempel, Cryptosporidium parvum). Mange av bakteriene kan klassifiseres gjennom en vanlig teknikk som kalles Gram -farging.
Noen bakteriegrupper krever imidlertid andre metoder for å identifisere dem. Teknikker som Ziehl-Neelsen-farging krever varmekombinasjoner med varme for å fikse den første til celleveggen.
Så kommer en misfargingsprosess som gjør det mulig å oppnå to resultater: motstand eller følsomhet for syre- og alkoholmisfarging.
Basis
Grunnlaget for denne fargingsteknikken er basert på egenskapene til celleveggen til disse mikroorganismene. Veggen dannes av en type fettsyrer som kalles mykolsyrer; Disse er preget av å presentere veldig lange kjeder.
Når fettsyrer har veldig lange strukturer, kan disse beholde fargestoffene lettere. Noen bakterie -sjangre er veldig vanskelige å farge ved gramfarging, på grunn av det høye innholdet av mykolsyrer fra celleveggen.
I Ziehl-Neelsen-farging brukes Fuchsin Carbol-fenolforbindelsen, et grunnleggende fargestoff. Dette har evnen til å samhandle med fettsyrene i celleveggen, som er av cerosa -tekstur ved romtemperatur.
Kan tjene deg: monosakkariderFarging med fuchsin karbol forbedres i nærvær av varme, fordi voksen smelter og fargeleggingsmolekylene beveger seg raskere inn i celleveggen.
Syren som ble brukt senere tjener til å misfarge cellene som ikke ble farget fordi veggen deres ikke var relatert til fargestoffet; Derfor er kraften til syresyre i stand til å eliminere syrefargestoffet. Cellene som motstår denne misfargingen kalles syrebestandig.
Sekundært fargestoff
Etter misfarging av prøven blir dette kontrast med et annet fargestoff som kalles sekundært fargestoff. Mustileo Blue eller Malachite Green brukes vanligvis.
Det sekundære fargestoffet flekker bakgrunnsmaterialet og skaper følgelig kontrast til strukturene som ble farget i første trinn. Bare misfargede celler absorberer det andre fargestoffet (motspenning) og tar fargen, mens syrebestandige celler beholder den røde fargen.
Denne prosedyren brukes ofte for identifisering av Mycobacterium tuberculosis og Mycobacterium Leprae, som kalles resistente syre-alkoholbaciller.
Reagenser
Primært fargestoff
0,3 % Fuchsin Carbol brukes (filtrert). Dette fargestoffet er fremstilt fra en blanding av alkoholer: etanolfenol (90 %) eller metanol (95 %), og i denne blandingen er 3 gram grunnleggende fuchsin oppløs.
Disoverende løsning
I dette trinnet kan du bruke 3 % alkoholsyreoppløsninger eller 25 % svovelsyre.
Sekundær fargelegging (motkrage)
Det mest brukte fargestoffet for å kontrastere i prøvene er vanligvis 0,3 % metylenblå. Imidlertid kan andre også brukes, for eksempel 0,5 % malakittgrønn.
Kan tjene deg: TiminaTeknikk
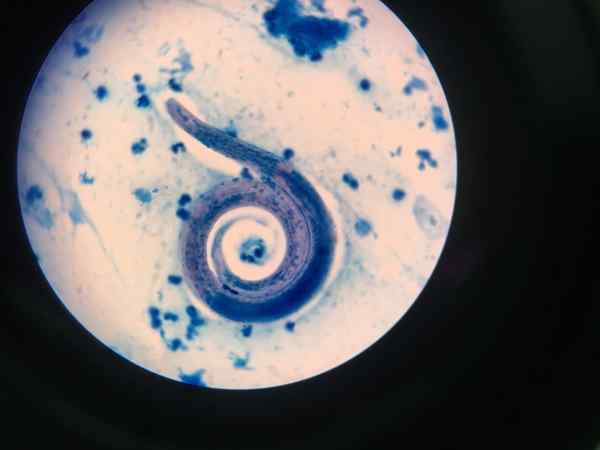 Nematode vist med Ziehl-Neelsen
Nematode vist med Ziehl-Neelsen Syreoptet fargingsprosedyre
Forbered en bakteriell smør
Denne preparatet gjøres på et rent og tørt lysbilde, etter forholdsregler for sterilitet.
Frovis tørking
La smøret tørke ved romtemperatur.
Varm prøven
Prøven må varmes opp ved å bruke brann på lysbildet nedenfor. En fiksering med alkohol kan lages når lukten ikke har tilberedt med sputum (behandlet med natriumhypokloritt for å bleke den), og hvis den ikke kommer til å bli farget umiddelbart.
M. tuberkulose elimineres med blekemiddel og under fargingsprosessen. Termofiksering av den ikke -behandlede sputum vil ikke drepe M. tuberkulose, Mens alkoholfiksering er bakteriemidler.
Dekk flekken
Flekken er dekket med Fuchsin Carbol Solution (primær grunnleggende fargelegging).
Varm flekken
Dette gjøres i 5 minutter. Du bør legge merke til en dampavløsning (ca. 60 ° C). Det er viktig å ikke overopphetes og unngå å brenne prøven.
I forhold til oppvarming av flekken, bør du være veldig forsiktig når du varmer opp Fuchsin -karbol, spesielt hvis fargingen blir utført på et brett eller annen beholder der det er samlet inn svært brennbare kjemikalier fra forrige tidligere farging.
Bare en liten flamme skal påføres under lysbildene ved hjelp av en vattpinne -belysning som tidligere er fuktet med noen få dråper sur alkohol, metanol eller 70 % etanol. Unngå å bruke en stor vattpinne dynket i etanol fordi dette er en risiko for brann.
Vask flekken
Denne vasken må gjøres med rent vann. Hvis tappevann ikke er rent, kan du vaske gni med filtrert eller destillert vann, helst.
Dekk smøret med syrealkohol
Denne syren alkohol må være på 3 %. Dekningen utføres i 5 minutter eller til lukten er tilstrekkelig misfarget, det vil si blekrosa.
Kan tjene deg: epiblastDet må tas i betraktning at sur alkohol er brannfarlig; Derfor bør det brukes veldig nøye. Unngå å være i nærheten av tenningskilder.
Vask flekken
Vask skal være med rent, destillert vann.
Dekk smøret med fargestoff
Det kan være malakittgrønn fargelegging (0,5 %) eller metylenblått (0,3 %) i 1 eller 2 minutter, ved bruk av høyere tid hvis lukten er tynn.
Vask flekken
Rent vann (destillert) skal brukes igjen.
Å drenere
Baksiden av lysbildet må rengjøres og flekken plasseres på en dreneringshylle, slik at den tørker i luften (ikke bruk absorberende papir for tørking).
Undersøk smøringen i mikroskopet
Målet med 100x og nedsenkningsolje skal brukes. Skann smøringen systematisk og skriv ned de relevante observasjonene.
Tolke resultatene
Teoretisk sett anses mikroorganismer som er farget fra en rødlig farge som positiv alkoholsyre (AAR+).
Tvert imot, hvis mikroorganismer er farget blå eller grønn, avhengig av fargestoffet som brukes som motkrage, regnes de som negativ resistent syre (AAR-).
Referanser
- Apurba, s. & Sandhya, B. (2016). Essentials of Practical Microbiology (1. utg.). Jaypee Brothers Medical Publisher.
- Bauman, r. (2014). Mikrobiologi med Deseodas av Body System (4. Ed.). Pearson Education, Inc.
- Heritage, J., Evans, e. & Killington, a. (nitten nittiseks). Innledende mikrobiologi (1. utg.). Cambridge University Press.
- Morello, J., Granato, p. Wilson, m. & Morton, V. (2006). Laboratoriehåndbok og arbeidsbok i mikrobiologi: Bruksområder til pasientbehandling (11. utg.). McGraw-Hill Education.
- Vasanthakumari, r. (2007). Lærebok for mikrobiologi (1. utg.). B.Yo. Publikasjoner Pvt.

