Karbonatom
- 2460
- 479
- Prof. Oskar Aas
Vi forklarer hva som er karbonatom, dets elektroniske struktur, egenskaper og orbital hybridisering.
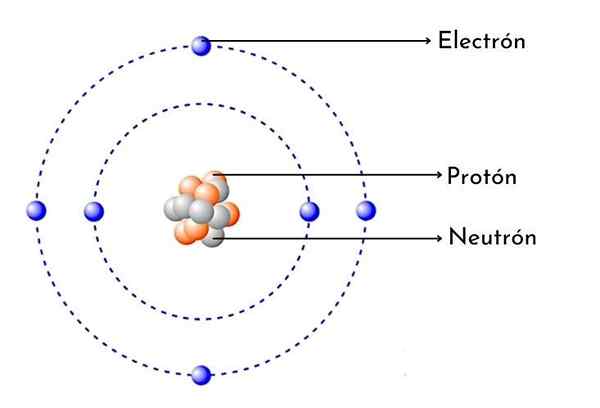
 Karbonatomskjema
Karbonatomskjema Hva er karbonatom?
Karbon er element nummer 6 i det periodiske bordet og er et av de viktigste elementene som finnes. Dets betydning oppstår fra en veldig rik og variert kjemi som får dette elementet til å danne Livets base på planeten Jorden, Som vi vet.
Det handler om en ikke-metall tilhører Gruppe 14 av det periodiske bordet (Tidligere gruppe 4A) og den andre perioden. I sin naturlige form er det assosiert med kull (både mineral og grønnsak) og sot, der det hovedsakelig er i form av grafitt eller annen alotrope.
Han Karbonatom Det er blant de minste av det periodiske bordet. Det er et tetravalent atom, det vil si at det kan dannes opptil fire lenker med andre atomer like eller forskjellige fra det samme.
Karbon er av stor betydning for mennesker. Det er en av hovedkomponentene i kroppen vår, og danner mer enn 19% av massen. I tillegg har den også flere teknologiske anvendelser avledet fra atomegenskapene.
Kjennetegn på karbonatom
- Karbonatomet er en ikke -metall: Karbon er et ikke -metallisk element som kan kombineres med mange andre elementer i det periodiske bordet. Karbonatomer kan tilegne seg eller gi elektroner til andre atomer, og blir henholdsvis anioner eller kationer.
- Den har 6 protoner i kjernen sin: Atomisk antall karbon er 6, noe som betyr at det har 6 protoner i kjernen sin. Det betyr også at et nøytralt karbonatom har 6 elektroner rundt kjernen.
Kan tjene deg: magnetisk separasjon- Det tilhører blokkering av det periodiske bordet: Den elektroniske karbonkonfigurasjonen i sin grunnleggende tilstand er 1s2 2s2 2 s2. Som det kan sees, er de siste Valencia -elektronene lokalisert i p -orbitaler, så karbonet tilhører blokkering av det periodiske bordet.
- Valensene til karbonatom er +2, +4 og -4: Karbonvalenslaget mangler bare 4 elektroner for å fylle helt og skaffe seg dermed den elektroniske konfigurasjonen av edel neongass. Av denne grunn kan karbon danne karbidanionen, C4-, som har 4 elektroner mer enn nøytralt karbon. På den annen side kan karbonatom også miste de to 2p -elektronene, og dermed bli karbonkationen (C2+), eller alle 4 elektronene i Valencia, og blir den karboniske kationen (C4+).
- Du kan danne flere alotropes: Elementær karbon kan finnes i to vanlige naturlige former som er grafitt og diamant, som har radikalt motsatte egenskaper. I tillegg kan du danne forskjellige karer, karbon- og grafen -nanorør.
De tre isotoper av karbonatom
Alle karbonatomer har seks protoner i kjernen, men ikke alle har samme antall nøytroner, noe som gir opphav til tre isotoper:
- Karbon-12 (12C): Det er den mest stabile og rikelig (ca. 98,9%). Den har 6 nøytroner i kjernen.
- Karbon-13 (1. 3C): Den har 7 nøytroner.
- Karbon-14 (14C): Det er radioaktivt bruk for datoene for gamle gjenstander.
Elektronisk struktur av karbonatom
Som hvert karbonatom har det seks positive protoner i kjernen, så har den også 6 elektroner Med negativ belastning snur seg.
Kan tjene deg: alikvot (kjemi)Måten disse elektronene er distribuert på eller den elektroniske konfigurasjonen av karbonatomet er:
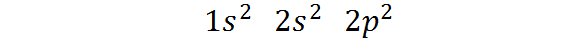
Denne elektroniske konfigurasjonen indikerer det Karbon har 2 elektroner i 1s orbital, To elektroner i orbital 2s, og To elektroner fordelt på de tre orbitalene 2p.
På den annen side er valenslaget for karbon laget L, som tilsvarer nivå n = 2, siden det er det høyeste nivået som inneholder elektroner. Som vi ser, har karbon totalt 4 elektroner på nivå 2, Så vi sier det Den har 4 Valencia -elektroner.
Dette er grunnen til at karbonet ligger der det tidligere ble kalt gruppe 4A av det periodiske bordet.
Atomisk orbital hybridisering i karbonatom
Atomer reagerer og kobler til hverandre gjennom valenselektronene og orbitale de okkuperer. Imidlertid har de sistnevnte ikke alltid tilstrekkelig orientering for å danne de nødvendige koblingene.
Valencias koblingsteori sier at atomer blander sine atomiske orbitaler for å danne nye hybrid orbitaler som har riktig veiledning. Denne prosessen kalles hybridisering.
Avhengig av antall atomer som et karbonatom er koblet til, vil det blande eller hybridisere et annet antall rene atombaner. Dette gir opphav til tre forskjellige hybridiseringer, Hva er de:
Sp
Oppstår når karbon bare er koblet til To atomer. I dette tilfellet er orbitalene med en av de tre p -orbitalene blandet, noe som gir opphav til to SP -orbitaler som peker i motsatte retninger (180º fra hverandre).
Kan tjene deg: MerkurbarometerDe to p -orbitalene som er igjen uten blanding brukes til å danne PI -bindinger. Karbonatom kan dannes En trippel lenke (som inneholder to pi -bindinger) med et enkelt atom, eller kan dannes To doble lenker, en med hvert atom (og med en koblingspi hver).
Sp2
Når karbon vil bli med Tre atomer, Du trenger tre hybride orbitaler, så bland tre rene orbitaler: orbital s og to orbitaler p. Dette genererer tre SP -hybride orbitaler2 som peker på hjørnene av en liksidig trekant.
Orbital P som ikke ble brukt, kan danne en PI -kobling med noen av de tre koblede atomer, og gi opphav til en dobbeltbinding.
Sp3
Når karbon kommer til å koble til Fire atomer, Bland de 4 rene orbitalene i valenslaget ditt for å generere 4 hybrid orbital SP3. Disse peker på toppunktene til en vanlig tetrahedron.
Ettersom det ikke er noen bane for å danne PI -bindinger, et karbon med SP -hybridisering3 Du kan bare danne fire enkle lenker og ingen flere lenker.
Referanser
- Britannica, redaktørene av Encyclopaedia. Karbon - Fakta, bruksområder og egenskaper. Hentet fra https: // www.Britannica.com/science/carbon-chemical-element
- Global Monitoring Laboratory. (s. F.). Karbonsyklus drivhusgasser. Hentet fra https: // gml.NOAA.Gov/CCG/Isotoper/kjemi.Html

