Typtofanegenskaper, struktur, funksjoner, fordeler
- 1015
- 206
- Oliver Christiansen
Han Tryptofan (TRP, W) er en aminosyre klassifisert i gruppen av essensielle aminosyrer, siden den menneskelige organismen ikke kan syntetisere den og må få den gjennom kostholdet.
Noen matvarer som melk og deres derivater, kjøtt, egg og noen frokostblandinger som quinoa og soya inneholder essensielle aminosyrer, og er derfor en viktig kilde til tryptofan.
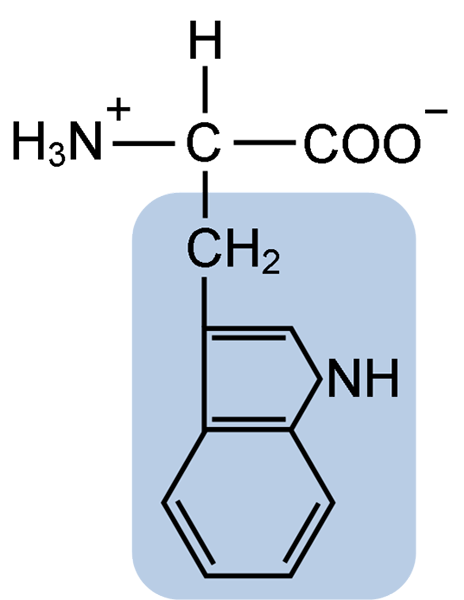
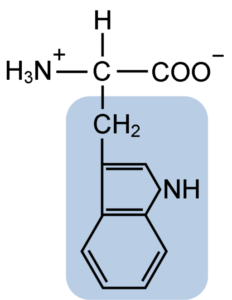 Kjemisk struktur av typtofanaminosyren (kilde: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Kjemisk struktur av typtofanaminosyren (kilde: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) I naturen er mer enn 300 forskjellige aminosyrer kjent, og bare 22 utgjør de monomere enhetene av celleproteiner. Blant de sistnevnte er 9 essensielle aminosyrer, inkludert tryptofan, men essensisen til hver enkelt er forskjellig mellom en art og en annen.
Tryptofan har forskjellige funksjoner, blant dem deres deltakelse i proteinsyntese, i syntesen av serotonin, som er en kraftig vasokonstriktor og nevrotransmitter, av melatonin og i syntesen av co -funder NAD.
I plantens rike er tryptofan en grunnleggende forløper for plantehormonet kjent som auxin (indol-3-eddiksyre). Det kan syntetiseres av noen bakterier som som OG. coli Fra korismato, som er produsert fra noen glykolytiske derivater som fosfoenolPivate og erytrosa-4-fosfat.
Dens nedbrytning hos pattedyr forekommer i leveren, hvor den brukes til syntese av acetylkoenzym A (acetyl-CoA), og av denne grunn beskrives det som en aminosyre kaller glukogen, siden den kan komme inn i glukosformasjonssyklusen.
Ulike studier er rapportert med kontroversielle resultater relatert til bruk av tryptofan som et kostholdstilskudd for behandling av noen patologier som depresjon og noen søvnforstyrrelser blant andre.
Det er noen sykdommer relatert til medfødte defekter i aminosyremetabolisme. Når det.
[TOC]
Kjennetegn
Sammen med fenylalanin og tyrosin finnes tryptofan i gruppen av aromatiske og hydrofobe aminosyrer.
Imidlertid er tryptofan preget av å være en litt hydrofob aminosyre siden dens aromatiske sidekjede, ved å ha polargrupper, demper den hydrofobisiteten.
For å ha kombinerte ringer har de en sterk absorpsjon av lys i spektrumområdet nær ultrafiolett, og denne egenskapen brukes ofte for strukturell analyse av proteiner.
Den absorberer ultrafiolett lys (mellom 250 og 290 nm), og selv om denne aminosyren ikke er veldig rikelig i strukturen til de fleste av menneskekroppsproteiner, representerer dens tilstedeværelse et viktig bidrag for lysabsorpsjonskapasiteten til lys i regionen av den 280 nm av de fleste proteiner.
Tryptophan daglige krav er forskjellige med alderen. Hos spedbarn mellom 4 og 6 måneder er gjennomsnittlig krav omtrent 17 mg per kilo vekt per dag; Hos barn i alderen 10 til 12 år er det 3,3 mg per kilo vekt per dag, og hos voksne er det 3,5 mg per kilo vekt per dag.
Tryptophan blir absorbert av tarmruten og er en ketogen og glykogen aminosyre samtidig.
Siden det er en serotoninforløper, en viktig nevrotransmitter, må tryptofanen nå sentralnervesystemet (CNS), og for dette må den krysse blodhjernebarrieren, som det er en spesifikk aktiv transportmekanisme.
Kan tjene deg: Biggy Agar: Foundation, Preparation and UsesStruktur
Tryptophan har en molekylær formel C11H12N2O2, og denne essensielle aminosyren har en aromatisk sidekjede.
Som alle aminosyrer har tryptofan et α -karbonatom festet til en aminogruppe (NH2), et hydrogenatom (H), en karboksylgruppe (COOH) og en sidekjede (R) dannet av en heterocyklisk struktur, Indol -gruppen.
Det kjemiske navnet er 2-amino-3-propionsyre, det har en molekylmasse på 204,23 g/mol. Dens løselighet ved 20 ° C er 1,06 g i 100 g vann og har en tetthet på 1,34 g/cm3.
Funksjoner
Hos mennesket brukes tryptofanen til proteinsyntese og er uunnværlig for serotonindannelse (5-hydroksitriptamin) en kraftig vasokonstriktor, stimulerer den glatte muskelkontraksjon (spesielt i tynntarmen) og en nevrotransmitter som er i stand til å generere psykisk stimulering og regulere angst.
Tryptophan er en forløper i syntesen av melatonin, og har derfor implikasjoner i søvn- og våkenesykluser.
Nevnte aminosyre brukes som en forløper på en av de tre måtene for dannelsen av NAD-kofaktoren, en veldig viktig kofaktor som deltar i en rekke enzymatiske reaksjoner relatert til oksidreduksjonshendelser.
Tryptofan og noen av dens forløpere brukes til dannelse av et vegetasjonshormon kalt auxin (indol-3-aktiv syre). Auxiner er plantehormoner som regulerer vekst, utvikling og mange andre fysiologiske funksjoner av planter.
Biosyntese
I organismer som er i stand til å syntetisere det, stammer karbonskjelettet til tryptofan fra fosfoenolpyruvatet og erytrosa-4-fosfat. Disse er på sin side dannet fra en mellomledd i Krebs -syklusen: Oxalacetate.
FosfoenolPiruvate og Erythrous-4-fosfat brukes til korismens syntese på en syv enzymatisk rute. FosfoenolPiruvate (PEP) er et produkt av glykolyse og erytrous-4-fosfat av pentosefosfatruten.
Hvordan er Corismate Synthesis -ruten?
Det første trinnet i symptomene på corismato er foreningen av PEP med Erythrosa-4-fosfat for å danne 2-ZO-3-Disoxxi-D-anabino-heptulosonato-7-fosfat (DAHP) (DAHP).
Denne reaksjonen katalyseres av enzymet 2-ZO-3-DEXXI-D-anabino-heptulosonato-7-fosfatsyntase (DAHP Syntasa), som blir hemmet av korismen.
Den andre reaksjonen innebærer ciclation av DAHP ved syntasen dehydrochinat, et enzym som krever co -faktor NAD, som reduseres under denne reaksjonen; Som et resultat oppstår 5-dishydroquinat.
Det tredje trinnet i denne ruten innebærer eliminering av et vannmolekyl av 5-dehydrokinat, reaksjon katalysert av enzymet dehydratase dehydrochinat, hvis sluttprodukt tilsvarer 5-Dishydro Shikimato.
Keto -gruppen av dette molekylet reduseres til en hydroksylgruppe, og som en konsekvens dannes Shikimato. Enzymet som katalyserer denne reaksjonen er den NADPH-avhengige avhengigheten.
Det femte trinnet i ruten innebærer dannelse av 5-fosfat shikimate og forbruk av et ATP-molekyl av et enzym kjent som kinase shikimato, ansvarlig for fosforylering av shikimate i posisjon 5.
Deretter, fra 5-fosfat shikimate og ved virkningen av 3-enlappiruvil shikimato-5-fosfatsyntase, genereres 3-enlappiruvil shikimato 5-fosfat. Det nevnte enzymet fremmer forskyvningen av fosforylgruppen til et andre pep-molekyl av hydroksylgruppen av karbon i posisjon 5 av 5-fosfat shikimate.
Det kan tjene deg: Hvorfor er det viktig å ta vare på biologisk mangfold?Den syvende og siste reaksjonen katalyseres av syntasekorismen, som eliminerer fosfat fra det 3-enlappate Shikimate 5-fosfat og gjør det til korismat.
I soppen N. Crassa, Et enkelt multifunksjonelt enzymatisk kompleks katalyserer fem av de syv reaksjonene på denne ruten, og dette komplekset tilsettes tre andre enzymer som ender opp med å generere tryptofan.
Tryptofansyntese i bakterier
I OG. coli, Tryptophan Corism Transformation inkluderer en fem ekstra enzymatisk rute:
Først omdanner det antranilatesyntase enzymet korismen til antranilat. I denne reaksjonen deltar et glutaminmolekyl, donert av aminogruppen som binder seg til indolringen til tryptofan og blir glutamat.
Det andre trinnet blir katalysert av fosforribosyltransferase -antranilat. I denne reaksjonen er et pyrofosfatmolekyl av 5-fosforribosyl-1-pyrofosfat (PRPP) (PRPP) rik på energi, og N- (5'-fosforribosyl) dannes.
Den tredje reaksjonen fra denne tryptofansyntese-ruten innebærer deltakelse av fosforribosyl-isomerase-enzymet. Her n- (5'-farribosyl) -Santhanylate.
Senere dannes det indol-3-glyserolfosfatet, i en reaksjon katalysert av indol-3-glyserol-sympati-syntasen, hvor en CO2 og et H2O-molekyl frigjøres og 1- (O-karboksyfenylamin) -1-desoxyribulosa 5-Phosphate.
Den siste reaksjonen på denne ruten ender opp med å danne tryptofan når tryptofansyntasen katalyserer.
Nedbrytning
Hos pattedyr blir tryptofan degradert i leveren til acetyl-CoA på en rute som involverer tolv enzymatiske trinn: åtte for å nå a-Zo-stadipat og 4 til for å konvertere a-Zo-dotadipato til acetylkoenzym til.
Rekkefølgen på nedbrytning til α-Cetoadipato er:
Typtofan → N-Quinureninformil → quinurenin → 3-hydroxi quinurenin → 3-hydroksy-antranilat → ε-semialdehyd 2-amino-3-mukycix mye → ε-semialdehido α-amino muconic amouz.
Enzymene som katalyserer disse reaksjonene er henholdsvis:
Typtophan 2-3-dioxigenase, Formamidase Quinurenine, NADPH-avhengig monooxigenase NADPH-avhengig.
Når a-metoadipat er generert, dannes oksidativ dekarboksylering gluteral-CoA. Dette ved ß-oksidasjon, glutakonyl-CoA-form som mister et bikarbonatkarbonatom (HCO3-), vinner et vannmolekyl og ender som Crotonil-CoA.
Crotonil-CoA, også for ß-oksidasjon, gir acetyl-CoA. Nevnte acetyl-CoA kan følge flere måter, blant dem glukoneogenese, for å danne glukose og Krebs-syklusen, for å danne ATP, etter behov, etter behov.
Imidlertid kan dette molekylet også rettes mot dannelsen av ketonlegemer, som endelig kan brukes som energikilde.
Mat rik på tryptofan
Rødt kjøtt generelt, kylling og fisk (spesielt blå fisk som laks og tunfisk) er spesielt rik på tryptofan. Melk og derivater, egg, spesielt eggeplommen, er også mat med mye tryptofaninnhold.
Andre matvarer som fungerer som en naturlig kilde til denne aminosyren er:
- Nøtter som nøtter, mandler, pistasjnøtter og Anacardos, blant andre.
- Risblandinger.
- Tørre korn som bønner, linser, kikerter, soyabønner, quinoa, etc.
- Ølgjær og friske bønner, bananer og bananer, ananas eller ananá, avokado, plommer, brønnkarse, brokkoli, spinat og sjokolade.
Det kan tjene deg: Submarine Shark: Historie, virkelighet eller fiksjon?Fordelene med inntaket ditt
Typtophan -forbruk er absolutt nødvendig for å syntetisere alle proteinene som inkluderer det i strukturen, og gjennom sine forskjellige funksjoner tillater det å regulere humør, søvn og våkenesykluser og et bredt utvalg av biokjemiske prosesser der NAD deltar.
I tillegg til de kjente effektene på humøret, griper serotonin (tryptofan avledet) inn i flere kognitive funksjoner relatert til læring og hukommelse som derfor også er relatert til tryptofan.
Det er data som viser forholdet mellom humør, serotonin og gastrointestinal-cerebral akse som et system med toveis påvirkning mellom hjerne-emosjonelle og kognitive sentre og perifer funksjon av fordøyelseskanalen.
Bruk som et kostholdstilskudd for behandling av noen lidelser, spesielt de som er relatert til sentralnervesystemet, har vært veldig kontroversiell fordi dens konkurrerende transport med nøytrale aminosyrer, mye rikere, gjør det vanskelig å oppnå betydelige og vedvarende økninger i tryptofan etter dens muntlige administrasjon.
Til tross for disse kontroversene, har bruken blitt postulert som et tillegg i:
- Smertebehandling
- Søvnforstyrrelser
- Depresjonsbehandling
- Manibehandling
- Appetittreduksjon
Mangelforstyrrelser
Den sentrale eliminering eller mangel på tryptofan er ledsaget av depresjon, svikt i oppmerksomhet, reduseres i hukommelse, søvn og angstlidelser.
Hos deprimerte pasienter og med selvmordstrender er det funnet endringer i konsentrasjonen av blod og cerebrospinalvæske. I tillegg viser noen pasienter med nervøs anoreksi lave serumnivåer av tryptofan.
Noen polyuriske pasienter, som mister vitamin B6 og sink, har ofte fobier og angst og forbedrer med kosttilskudd rik på triptofan.
Karsinoidsyndrom er preget av tilstedeværelsen av tynntarmssvulster som forårsaker diaré, vaskulære sykdommer og bronkokonstriksjon og er relatert til niacin og tripofanunderskudd
Pelagra er en patologisk tilstand som er ledsaget av diaré, demens, dermatitt og kan forårsake død, dette blir også behandlet med niacin og tryptofan -tilskudd.
Hartnups sykdom må gjøre, blant noen ting, med en defekt i metabolismen til flere aminosyrer, inkludert tryptofan.
I tilfelle ved underskudd av typtofan -2,3-monoksigenase-enzym, er dette en recessiv arvelig sykdom som er preget av psykisk utviklingshemning og hudforandringer av hudtypen.
Referanser
- Halvorsen, k., & Halvorsen, S. (1963). Hartnup sykdom. Pediatri, 31(1), 29-38.
- Hette, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Don's Panic. En guide til uttømming av tryptofan med forstyrrelsesspesifikk angstprovokasjon. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. TIL., Nguyen, J. C., Pollaze, k. OG., & Bertrand, P. P. (2016). Påvirkning av tryptofan og serotonin på humør og erkjennelse med en mulig rolle av tarm-aksen. Næringsstoffer, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. TIL., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Angstdempende effekter av akutt tryptofan -uttømming i anorexia nervosa. International Journal of Eating Disorders, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, s., & Rodwell, V. (2009). Harpers illustrerte biokjemi. 28 (s. 588). New York: McGraw-Hill.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.

